酸蛋白沉淀-原子荧光光谱法测量血铅
1. 简介
铅是一种著名的有毒元素,尤其对人体健康有很大损害[1],可以造成消化道,造血系统与神经系统受损,对人体(特别是儿童)危害很大。一旦铅被吸收到人的血液中,就会快速沉积到软组织中,进而进入到骨组织中,它的残留时间长达十年[2]。研究表明,儿童血铅水平每上升100μg/L,身高会降低1.3cm,智商会下降0.25个百分点。同样显示当孕妇血液中的含铅量达到65μg/L时,不但会对分娩造成损害,而且会破坏婴儿神经系统的发展[3]。当前检测人体铅含量主要依靠对血铅的检测,在应用到测铅的各种技术中[4-18],主要有锌原卟啉法、微分电位溶出法、石墨炉原子吸收法、ETAAS、ICP-MS、氢化物发生-原子荧光光谱法等。其中前两种方法检出限较高,测定准确度较差;石墨炉原子吸收法是当前血铅测定的标准方法,但其仪器成本较高,操作较为复杂;而ETAAS对于基体的组成非常敏感,会造成严重的基体效应[19],对固溶物总量的要求限制了ICP-MS在生物样品中的应用;近年来氢化物发生-原子荧光光谱法用于血铅测定已经有了较好的实践[20、21],这一方法能够真正做到微量、准确、廉价、便利的测量血铅,所以非常易于推广。
当前,采用氢化物发生-原子荧光光谱法测血铅仍存在一些缺陷,主要集中在两个方面:首先是氢化物发生-原子荧光光谱法测血铅时要求对样品进行消解,但其采样量一般在50~100μL,消解液的加入量在0.5~1.0mL,无法使用密闭罐微波消解,而只能使用电热板消解,这就造成其消解过程耗时长且易污染;另一方面,氢化物发生-原子荧光光谱法测血铅时对反应的酸度要求很高,一般酸度窗口小于0.5%,稍有偏差就会造成测量结果显著偏低。本文针对上述两个问题分别提出了相应的解决办法:采用酸蛋白沉淀离心的方法处理血样,不但操作简单易行,大大节省了样品前处理的时间,而且还减少了污染的几率,保证了测量的准确性和可靠性;另外,我们摸索出了一种新的还原剂配比,可以将酸度窗口扩展到1%左右,较好的解决了HGAFS测铅时的酸度问题。
2. 实验部分
2.1 实验仪器
本工作采用北京吉天公司的AFS-9130氢化物发生-原子荧光光谱仪测铅,该仪器的气路、 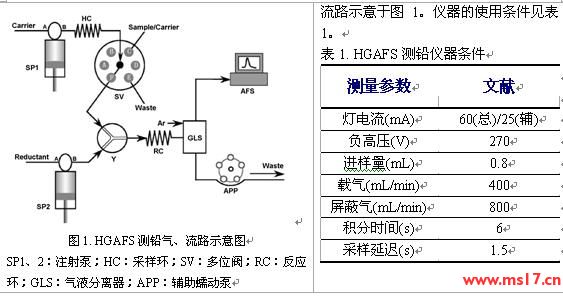
2.2 实验试剂
载流溶液使用3.5%的HNO3,标准溶液由1000mg/L的铅标准溶液(GBW08611)逐级稀释到10μg/L得到,该溶液中也含有3.5%的HNO3;还原剂包括30g/L NaOH+10g/L KBH4+20g/L K3[Fe(CN)6]+10 g/L H3BO3,使用的试剂见表2,
表2 HGAFS测血铅所用试剂
|
试剂 |
规格 |
生产厂 |
|
水 |
>15MΩ |
实验室二次水 |
|
盐酸 |
BV-Ⅲ |
北京化学试剂研究所 |
|
高氯酸 |
优级纯 |
北京南尚乐化工厂 |
|
硝酸 |
BV-Ⅲ |
北京化学试剂研究所 |
|
氢氧化钠 |
优级纯 |
中国福利企业华东公司(苏州) |
|
硼氰化钾 |
>98% |
天津市津科精细化工研究所 |
|
铁氰化钾 |
分析纯 |
广东汕头市西陇化工厂 |
|
硼酸 |
优级纯 |
北京化学试剂公司 |
2.3 操作过程
为了减少测定血铅过程中进样量并且减少记忆效而采用顺序注射,顺序注射程序见表
3所示,
表3 HGAFS测铅顺序注射条件
|
时间(s) |
样品注射泵 |
多位阀位 |
还原剂注射泵 |
蠕动泵速 |
读数 |
自动配制 |
|||||
|
阀位 |
动作 |
体积 |
阀位 |
动作 |
体积 |
|
样品 |
空白 |
|||
|
1 |
A |
Fill |
1.5 |
G |
B |
Fill |
0 |
130 |
|
|
|
|
1 |
B |
Fill |
0.8 |
G |
B |
Fill |
0 |
0 |
|
|
|
|
1 |
B |
Inject |
2.3 |
E |
B |
Inject |
0 |
0 |
|
|
|
|
0.5 |
A |
Fill |
1.6 |
G |
B |
Fill |
1.85 |
130 |
|
|
√ |
|
0.5 |
B |
Fill |
0.8 |
G |
B |
Fill |
1 |
0 |
|
√ |
|
|
0.5 |
B |
Fill |
1.2 |
G |
B |
Inject |
0.5 |
0 |
|
|
|
|
6 |
B |
Inject |
3.6 |
B |
A |
Inject |
2.35 |
140 |
√ |
|
|
在清洗后的离心管中每支加入2.9mL载流,然后加入100μL血样(相当于稀释30倍),都在旋涡混合器上振荡混合30~60s,再静置2~10min,然后在12000转/分下离心10min,离心完毕,得到澄清透明的溶液,取出按操作2.3进行测定,得到血样中的含铅量。
2.5 结果计算
将测得的血样中的含铅量减去样品空白中的含铅量,然后再乘以稀释倍数即可得到血样中的铅浓度。数据处理使用SPSS11.0进行统计学计算。
3. 结果与讨论
3.1 进样方式及反应气泡的影响
目前原子荧光主要有两种进样方式, 一种是蠕动泵进样,它的特点是进样精度低,需要过量进样,靠管路来定量,进样体积一般大于1.5mL,自动化程度较低,试剂比例调整比较困难;另一种是注射泵进样,特点是进样精度高,进样量小,一般为0.3~0.8 mL,自动化程度较高,可以自动配制标准曲线,试剂比例调整容易。从进样精度、自动化程度、试剂比例调整几个方面综合分析考虑,注射泵进样比蠕动泵进样具有更大的优势,所以本实验采用注射泵进样。
由于本方法采用的血样前处理的方法是酸蛋白沉淀,GFAAS结果证明酸蛋白沉淀法能将血中的铅有效提取到上清液中,但是其中含有一定量的有机质。氢化物反应会大量产气,而上清液当中含有大量的有机质,会在测量时产生大量气泡,干扰测定,甚至损毁仪器,因此控制反应气泡的产生对整个测量的影响至关重要。控制反应气泡首先可以从离心条件考虑,通过选择合适的离心转速、时间以及取血量,使得离心后获得的待测液中尽可能澄清透明,减少有机质的含量。此外用于氢化物的反应是一个动态的平衡,在进入气液分离器之前就发生激烈反应,产生的气泡分两种,一种是进气液分离器前产生的一次气泡,大量气泡主要都是一次气泡产生,这可以通过减少进样量以及使用化学气相发生气液分离装置来消除一次气泡;第二种是在进入气液分离器后,反应尚未达到平衡,在气液分离器中继续反应产生二次气泡,可以通过提高排废的泵速来防止二次气泡的产生。
3.2 酸度的影响
氢化物发生-原子荧光(HG-AFS)测铅始终较难操作,主要是因为该反应体系对酸度的要求太高,一般酸度窗口小于0.5%,稍有偏差就会造成测量结果显著偏低。首先我们采用1%的HNO3载流,0.5%的NaOH的还原剂,分别测试了0.3%、0.5%、1%、1.2%、1.5%、2%的HNO3溶液配得的10μgl-1铅标准溶液,得到不同酸度条件下的工作曲线,以工作曲线的斜率作为纵坐标,酸度作为横坐标,得到不同酸度对铅测定的影响。
然后我们采用了新的还原剂配比,用4%的HNO3载流,分别测试了用3%、3.5%、4%、4.5%、5%的HNO3溶液配得的10μgl-1铅标准溶液,得到不同酸度条件下的工作曲线,同样以工作曲线的斜率作为纵坐标,酸度作为横坐标,得到不同酸度对铅测定的影响,如图2

图2 酸度对测定铅的影响
从图2可以看出,当还原剂中NaOH的浓度为0.5%时,在酸度为0.5~1.0%之间测量灵敏度基本不变,但这个酸度范围只有0.5%,这是由于反应形成的体系缓冲容量很小,导致酸度范围非常窄;当还原剂中NaOH的浓度为3%时并且其中含有1%的硼酸时,形成了缓冲容量较大的缓冲体系,测量灵敏度在酸度3.5%~4.5%之间有一个平台,使得酸度范围拓展到1%左右,所以我们在本实验中选择载流为3.5%的HNO3,能保证测量结果稳定可靠。
3.3 仪器条件的选择
我们还考察了载气流量、屏蔽气流量、KBH4浓度、辅阴极电流等因素对测量的影响,从测量的灵敏度和稳定性方面考虑,得到本方法中测量的仪器条件:流量为400mL/min,屏蔽气流量为800 mL/min,KBH4浓度为1%,辅阴极电流为25mA,总电流为60mA,见表1。
3.4 干扰离子的影响
配制100μgl-1的铅标准溶液,分别使其含有Mg2+、Fe3+、Zn2+、Co2+、Cd2+、Ni2+、Ca2+、Cu2+8种离子,浓度分别为:80、500、50、50、50、50、80、8mgl-1,然后测定该标准溶液,所得结果见表4,
表4 全血中部分常量元素和微量元素对铅测定的干扰(测定100μgl-1铅标准溶液)
|
干扰离子 |
离子浓度(mgl-1) |
倍数 |
铅测定结果(μgl-1) |
|
Mg2+ |
80 |
800 |
100.5 |
|
Fe3+ |
500 |
5000 |
97.8 |
|
Zn2+ |
50 |
500 |
96.7 |
|
Co2+ |
50 |
500 |
99.8 |
|
Cd2+ |
50 |
500 |
101.4 |
|
Ni2+ |
50 |
500 |
101.0 |
|
Ca2+ |
80 |
800 |
98.9 |
|
Cu2+ |
8 |
80 |
101.2 |
|
Cr3+ |
50 |
500 |
100.8 |
3.5 工作曲线
本工作配制10μgl-1的铅标准溶液,然后自动稀释,按照表3的顺序注射条件,得到工作曲线为If =197.0C-14.7,相关系数R=0.9998,检测限是3.4μgl-1,连续11次测量10μgl-1的铅标准溶液,得到相对标准偏差RSD=0.99%。
3.6 标准血样测定及加标回收率
用上述的方法测定两个国家一级标准物质冻干牛全血标准样品GBW09139和GBW09140,以及两个实际人全血样品和加标回收,得到测定结果见表5,
表5 标准冻干牛血和人全血的测定
|
样品 |
标准值/μgl-1 |
测定值/μgl-1 |
加标浓度/μgl-1 |
回收率(%) |
|
GBW09139 |
96±20 |
93±11 |
|
|
|
GBW09140 |
248±35 |
241±14 |
|
|
|
血样1 |
|
85±12 |
100 |
103 |
|
血样2 |
|
84±14 |
100 |
97 |
由表5可知,测定两个标准冻干牛血样品得到的测定值分别是93±11 μgl-1和241±14 μgl-1,都在标准值的允许范围内,测定的准确性很好;而且测定了两个人全血的样品,并且加浓度为100μgl-1的铅标准溶液,测得回收率都在95~105%,保证了测量方法的可靠性。
3.7 AFS与AAS的对比实验
应用原子荧光法(AFS)和石墨炉原子吸收法(AAS)分别测定20份全血铅的含量。原子荧光法测定的结果是:51.4、41.1、95.4、59.1、142.1、47.1、35.0、114.5、61.9、36.7、68.8、72.4、117.1、125.4、55.0、34.2、76.2、72.0、110.6、73.6μgl-1;相对应的用石墨炉原子吸收法测定的结果是:52.8、41.6、95.5、61.5、139.4、48.0、32.3、108.9、60.6、36.6、70.8、71.1、120.3、113.9、52.0、34.1、75.4、70.1、115.1、73.9μgl-1。以石墨炉原子吸收法作为参照,得到回归方程为Y = 1.500 + 0.969X (Y:原子吸收;X:原子荧光),相关系数R=0.9946(如图3),说明一致度很好;而且通过两种方法的配对t检验t = 1.018,P= 0.321 >0.05,说明两组数据无统计学差异,两种测定方法不存在方法学误差。

图3 石墨炉原子吸收与原子荧光测量相关性
4. 结论
本方法具有很好的选择性、准确性、可靠性和精密度,而且操作方便,成本低廉,适于绝大部分医疗机构对铅的测定。
参考文献:
[1] Centers for Disease Control and Prevention, Preventing Lead Poisoning in Young Children Report), US Department of Health and Human Services, Atlanta, GA, 1991.
[2] J. A. Brito, F. E. McNeill, D. R. Chettle, C. E. Webber and C. Vaillancourt, J. Environ. Monit., 2000, 3, 271.
[3] Z.-L. Luo, J.-P. Liu, J.-A. Liu and F.-Z. Li, Chin. J. Tradit. West. Med., 2003, 10, 1479.
[4] I. D. Brindle, R. McLaughlin and N. Tangtreamjitmun, Spectrochim. Acta, Part B, 1998, 53, 1121.
[5] M. C. V.-H. Temprano, M. R. F. de la Campa and A. Sanz-Medel, Anal. Chim. Acta, 1995, 309, 369.
[6] M. T. Baranguan, F. Laborda and J. R. Castillo, Anal. Bioanal.Chem., 2002, 374, 115.
[7] X. Liu, S. Xu and Z. Fang, At. Spectrosc., 1994, 15, 229.
[8] N. Vural and Y. Duydu, Sci. Tot. Environ., 1995, 171, 183.
[9] J. F. Tyson, R. I. Ellis, G. Carnrick and F. Fernandez, Talanta, 2000, 52, 403.
[10] H. O. Haug, Spectrochim. Acta, Part B, 1996, 51, 1425.
[11] D. Erber, L. Quick, F. Winter and K. Cammann, Talanta, 1995,42, 927.
[12] S. Chen, Z. Zhang, H. Yu, W. Liu and M. Sun, Anal. Chim. Acta, 2002, 463, 177.
[13] J. Li, F. Lu, T. Umemura and K. Tsunoda, Anal. Chim. Acta, 2000, 419, 65.
[14] Y. Zhou, R. A. Zanao, F. Barbosa Jr., P. J. Parsons and F. J.Krug, Spectrochim. Acta, Part B, 2002, 57, 1291.
[15] P. J. Parsons, C. Geraghty and M. F. Verostek, Spectrochim. Acta, Part B, 2001, 56, 1593.
[16] W. I. Manton, S. J. Rothenberg and M. Manalo, Environ. Res.Sect. A, 2001, 86, 263.
[17] A. Schutz, I. A. Bergdahl, A. Eckholm and S. Skerfving, Occup. Environ. Med., 1996, 53, 736.
[18] J. H. Wang and E. H. Hansen, J. Anal. At. Spectrom., 2002, 17, 1284.
[19] M. Grotti, R. Leardi, C. Gnecco and R. Frache, Spectrochim. Acta, Part B, 1999, 54, 845.
[20] Wang JH, Yu YL, Du Z, Fang ZL JAAS,2004, 19: 1559-1563
[21] 叶涛,赵志成,吕莉,中华检验医学杂志,2003, 26(11):677-679
Determination of Lead in Blood by Acid Protein Deposition-AFS
De-Yuan Qin, Ji-Xin Liu
Titan Instruments Co.,Ltd, Beijing, China,100016
Abstract. Adopting acid protein deposition centrifugation to deal with whole blood samples in this article, and we discussed all kinds of instrument conditions, attaining that carrier solution is 3.5% HNO3, the flow rate of carrier gas and shield gas is 400mL/min and 800mL/min respectively, KBH4 concentration is 1%, auxiliary cathode current is 25mA; furthermore adding all kinds of interference ions to100μgl-1 lead standard solution, the results showed that physiological concentration of common two-value cation had no significant interferences to determine lead by atomic fluorescence; applying this method to determine standard frozen cattle blood samples, the determination value was 93±11μgl-1 and 241±14μgl-1 respectively, and it was among the permission range of standard value; besides determining two human whole blood samples and the recovery of adding lead standard solution, the recovery ratio were between 95%~105%. Determination of 20 shares of whole blood samples by AFS compared with AAS, there was no significant difference between two methods.
Keywords: lead; acid protein deposition; atomic fluorescence

关注本网官方微信 随时阅权威资讯


