光谱仪在药学专业实验教学中的应用和探索
光谱仪在药学专业实验教学中的应用和探索
张筱宜1,2,张佳宁1,赵明1,2*
(1.首都医科大学化学生物学与药学院 北京 100069;2.首都医科大学基础与专业国家级药学实验教学中心,北京 100069)
摘 要: 为培养顺应时代发展需要的创新和创业型药学人才,根据光谱分析技术是药物研究中的常用方法和手段这一特点,设计了适合药学本科学生学习的实验教学内容,探索了将新药研究的科研仪器设备应用于实验教学的具体方法。实践表明,这种以仪器设备为基础的实验教学模式,一方面提高了仪器的使用效益,另一方面给学生提供了亲自操作大型仪器的能力和更广阔的学习空间。这无疑是一次探索如何开展药学本科生大型仪器实验教学的有益尝试。
关键词: 紫外-可见分光光度计;荧光分光光度计;圆二色谱仪;药学专业实验
中图分类号:G642
Spectrometer Application in “Experiment for Pharmacy Specialty” Course
Zhang Xiaoyi1,2, Zhang Jia-ning1, Zhao Ming1,2
(1.School of Chemical Biology and Pharmaceutical Sciences, Capital Medical University, Beijing, 100069; 2. Chemical and Pharmaceutical National Experimental Teaching Center of Pharmaceutical Sciences, Capital Medical University, Beijing, 100069)
Abstract: In order to meet the urgent need for cultivation of innovative and entrepreneurial talents, the experiment of small molecule intercalation with calf thymus DNA was introduced in undergraduate courses “Experiment for Pharmacy Specialty”, basing on the characteristics of spectral analysis technology, which is commonly used in drug research. We also explored the application of scientific researching instruments in the experimental teaching. The teaching practice indicated that this kind of instrument-based experimental teaching model was beneficial to improve the efficiency of the instruments, help the students gain hands-on operation experience of spectrometers and provide students with more learning opportunities. Undoubtedly, this is a good way to explore how to carry out the experimental teaching of major instruments at the undergraduate level.
Key words: UV/Vis spectrophotometer, fluorescence spectrophotometer, circular dichroism spectrometer, experiment for pharmacy specialty
光谱仪,如紫外-可见分光光度计、傅里叶变换红外分光光度计、荧光分光光度计、拉曼光谱仪等,是一大类应用广泛的分析仪器。光谱分析技术已成为化学合成、材料科学、环境和食品工程等领域中必不可少的方法和手段。特别是在药学领域,紫外-可见、荧光、圆二色散等光谱数据对于研究药物小分子与蛋白质或者DNA大分子的相互作用方式和强弱具有重要价值 ADDIN EN.CITE ADDIN EN.CITE.DATA [1-5]。
作为首都医科大学(以下简称“首医”)化学生物学与药学院的教师,借助“首医”基础与专业国家级药学实验教学示范中心,借助“首医”大型仪器药学平台的新型、全面、综合等优势,笔者以自己的科研工作为基础,将光谱仪的应用引入大学生药学专业实验教学中,设计了一系列适合本科生的创新性实验“抗肿瘤分子姜黄素与DNA相互作用的光谱学性质分析”。作为实践,光谱仪在药学本科生专业实验中的应用进行了9年多,结果表明,该实验课程的实施摈弃了大学生观摩仪器的实验,而是让本科生亲自操作各种光谱仪,加深和巩固了学生对紫外-可见分光光度计(UV/Vis Spectrophotometer,UV/Vis)、荧光分光光度计(Fluorescence Spectrometer,FS)和圆二色散光谱仪(Circular Dichroism Spectrometer,CD)的构造和原理等理论知识的理解,并使用光谱仪进行测试,真正做到了学以致用,大大地激发了学生使用大型仪器的兴趣和积极性;另一方面引导学生查阅和跟踪文献,了解光谱仪在小分子药物与大分子相互作用研究领域的最新进展,开阔视野,培养科学兴趣、科学素质和科研探究能力。
1. 实验背景
DNA是核苷酸的聚合物,由五碳糖和磷酸骨架及含氮碱基组成,并形成双螺旋结构,是抗肿瘤药物发挥药效的靶分子之一。例如,在临床上广泛应用的抗肿瘤药阿霉素(多柔比星)是通过嵌入癌细胞的DNA碱基片段中,阻碍DNA的转录和复制,从而抑制肿瘤生长,是众所周知的DNA嵌插剂 ADDIN EN.CITE ADDIN EN.CITE.DATA [6-8]。通常认为小分子药物以形成非共价键的方式与DNA相互作用的方式主要有3种 ADDIN EN.CITE ADDIN EN.CITE.DATA [9, 10]:① 垂直地插入DNA分子的双螺旋碱基之间的嵌插作用,导致DNA的骨架发生形变(图1 B);② 与DNA分子的带负电荷的核糖-磷酸基骨架之间的静电作用(图1 A);③ 通过非特异性的静电作用结合到负电荷的DNA双螺旋外部的沟槽作用(图1 C)。
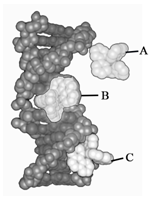
图1. 小分子药物与DNA相互作用示意图A:静电作用;B:嵌插作用;C:沟槽作用
当小分子药物和DNA发生作用时,DNA的光谱学性质如紫外光谱、荧光光谱、圆二色散光谱等会发生明显变化 ADDIN EN.CITE ADDIN EN.CITE.DATA [11-16]。提示我们,可以借助常规的光谱仪,通过宏观测试,观察微观世界中小分子化合物与DNA的相互作用,从而可以预测药物研究中的先导化合物。据此,笔者根据前期工作经验,选择传统中药姜黄中具有抗肿瘤活性的主要成分姜黄素(Cur,图2)为研究对象,设计利用紫外-可见光光谱,荧光光谱和圆二色散光谱等三种光谱手段,研究Cur与小牛胸腺DNA(CT-DNA,图3)的作用。
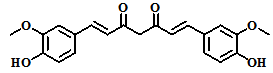
图 2. 姜黄素的结构
图 3. 小牛胸腺DNACT-DNA的结构
2. 实验方法
2.1 实验材料
CT-DNA(小牛胸腺CT-DNA):Sigma公司,42%GC含量,为B型DNA。
DMSO:Hyclone公司;
PBS:每升溶液中含有NaCl8.2g,KCl0.20g,Na2HPO4H2O1.56g,KH2PO4 0.2g,pH为7.4;
待测样品储备液的配制:精密称取化合物Cur样品,用含10%DMSO的PBS缓冲液溶解,配制成浓度为2.0 ×10-3mol/L的储备液备用;
CT-DNA储备液的配制:CT-DNA用PBS溶解,浓度为 C=2.0×10-3mol/L( 由紫外分光光度计标ε260 = 6600 (mol/L)-1 /cm,纯度A260/A280=1.9( 即:其中不含干扰测定的蛋白质) ADDIN EN.CITE ADDIN EN.CITE.DATA [17, 18]。该储备液于4℃冰箱冷藏保存,存放不超过四天;
实验用水均为三蒸水,经检测无荧光杂质。
2.2 实验仪器
紫外可见分光光度计:UV-2550,波长测定范围190-900 nm,岛津公司;
荧光分光光度计:RF-5301PC,波长测定范围 220~900 nm,岛津公司;
圆二色谱仪: J-810,波长测定范围163 nm~900 nm,Jasco公司;
2.3 实验内容
1)紫外光谱测定
将2 ml浓度为2.0×10-6mol/L的化合物Cur置于比色杯中,测定紫外光谱;逐次向比色杯中加入10 μl浓度为2.0×10-4 mol/L CT-DNA溶液(每次加入10 μl,视为保持测试体系体积不变,即体系浓度保持恒定),5 min后,测定混合液的紫外光谱(CT-DNA的终浓度分别为(0、1.0、2.0、4.0、8.0、16.0、32.0、64.0、128.0、256 μM );考察化合物Cur与CT-DNA结合前后紫外光谱的变化,结果见图4。
2)荧光猝灭光谱测定
移取2.0×10-6 mol/L的化合物Cur置于石英比色杯中,测定荧光光谱;逐次向比色杯中加入浓度为2.0×10-4 mol/LCT-DNA溶液(每次加入10 μl,故认为保持测试体系体积不变,即体系浓度保持恒定),5 min后,测定荧光猝灭光谱(CT-DNA的终浓度分别为 ( 0、1.0、2.0、4.0、8.0、16.0、32.0、64.0、128.0、256 μM )。 荧光发射和激发狭缝分别为10 nm,5 nm,固定激发波长450 nm,扫描速度为1000 nm/min,发射光谱范围460~660 nm,37 ℃条件下测定,结果见图5。
3) 圆二色散光谱测定
取 2 × 10-4mol/L化合物Cur 各100 μ1和900 μl 1 × 10-4 mol/L CT-DNA溶液混合,37 ℃孵育3h。圆二色散谱测定实验中采用0.1 cm的样品池,参数如下:scan speed 500 nm/min,resolution step 0.2nm,sensitivity 50 mdeg,k = 200-350 nm,response 0.5s,bandwidth 15 nm,accumulations 5。在氮气条件下,室温,230-350 nm范围内,分别测定CT-DNA溶液,化合物Cur和CT-DNA混合液的圆二色散光谱,结果见图6。
3. 结果与讨论
3.1化合物Cur 与CT-DNA作用前后紫外光谱的变化
当小分子与CT-DNA发生相互作用时,不同的作用方式会使紫外光谱表现出不同的变化。文献报道,当这种方式是小分子插入CT-DNA分子的双螺旋碱基之间的嵌插作用时,如前面所述的第一种作用方式。这样作用的结果,可使小分子化合物的紫外光谱吸收强度降低(减色效应),通常吸收强度可降低30-50 %);如果作用方式非特异性的静电作用结合到负电荷的CT-DNA双螺旋外部的沟槽作用,如上面所述的第三种作用方式。这样作用的结果,紫外光谱可能不表现上述变化,或者变化很微弱。因为当小分子以嵌插方式结合于DNA碱基对之间时,会发生π-π堆积效应,使π*空轨道与碱基对的π电子轨道发生耦合,耦合后π轨道因部分填充电子使π-π*跃迁几率减小,产生减色效应 ADDIN EN.CITE ADDIN EN.CITE.DATA [19, 20]。
由于CT-DNA在大于300 nm的范围内无紫外吸收,因而选择300-500 nm范围测定化合物Cur的以及化合物Cur和CT-DNA作用后的紫外光谱(图4)。从图中可以看出:游离的化合物Cur在300-500 nm范围内最大吸收波长为431 nm,吸收强度为0.811;随着CT-DNA的含量不断增加,化合物Cur的最大吸收波长位置未发生明显变化,发生减色现象。当CT-DNA的浓度为256.0 μM时,化合物Cur的吸光强度降低至0.370,减小了54.4%。此时,再增加CT-DNA的含量,化合物Cur的紫外光谱基本保持不变。化合物Cur和DNA作用后紫外光谱的变化,提示这种模式可能是嵌插作用。
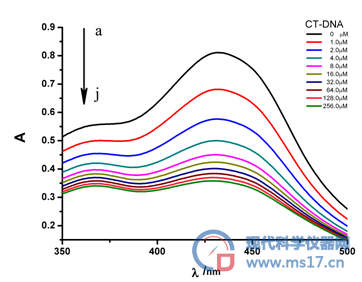
图4. 不同浓度的CT-DNA(a-j)对Cur (2.0*10-6mol/L)紫外吸收光谱的影响
3.2 CT-DNA对化合物Cur的荧光猝灭光谱
目前普遍认为,小分子与DNA的相互作用会导致小分子荧光光谱中荧光强度明显改变,但是这种改变是增强还是减弱以及荧光强度的改变和作用方式的关系都是不确定的。Stockert等人发现,当偏端霉素结合于CT-DNA的小沟时,偏端霉素的荧光吸收显著增加;而和双链DNA的沟槽结合作用,会导致萘普生发生荧光猝灭;经典的DNA嵌插剂溴乙啶和双链DNA作用,增加了自身荧光强度 ADDIN EN.CITE ADDIN EN.CITE.DATA [21-23]。
图5 表明:在pH = 7.4的PBS缓冲液中,游离的化合物Cur最大发射波长为496 nm。保持化合物Cur 的浓度保持不变,随着CT-DNA的含量增加,化合物Cur的内源荧光强度有规律的降低,峰位变化较小。当CT-DNA的浓度为256.0 μM时,荧光强度为117.69,降低了63.6%。
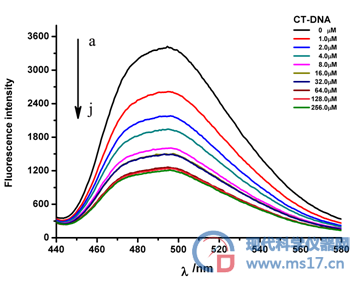
图5. 不同浓度的CT-DNA(a-j)对Cur (2.0*10-6mol/L)荧光发射光谱的影响
3.3 圆二色谱研究化合物Cur和CT-DNA的相互作用
圆二色谱(CD)技术是一种利用平面偏振光研究溶液中DNA 等生物大分子高级结构的快速、简单、准确的方法(DNA的 CD信号由不对称的主链上的核糖分子以及螺旋结构产生),该技术在小分子药物与DNA相互作用研究中得到很多应用,是强有力的工具。本实验选用的CT-DNA为B构型DNA。CD谱中,在280
nm附近出现正性带,在245 nm附近出现负性带,与基线轴交汇于约260 nm 附近,这是B构型DNA的典型特征。CD谱图正性带和负性带是由堆积的碱基之间的电子跃迁偶极矩的偶合产生 ADDIN EN.CITE刘振佳201034343417刘振佳司伊康陈晓光中国医学科学院北京协和医学院药物研究所;圆二色谱测定技术在小分子化合物与DNA相互作用研究中的应用药学学报药学学报1478-148312圆二色谱诱导圆二色谱抗肿瘤药药物与DNA相互作用DNA嵌入DNA沟结合20100513-487011-2163/R
据文献报道,对于没有手性的小分子化合物而言,当小分子化合物和DNA相互作用模式为嵌插作用时,由于小分子在碱基对之间的堆积效应,导致DNA圆二色散谱的正吸收带吸收强度增强,在数值上表现为摩尔椭圆率的增大;当小分子和DNA相互作用模式为沟槽作用时,DNA的CD谱无明显变化;对于含有手性中心的小分子化合物来说,DNA的CD谱的变化比较复杂,要根据二者的作用模式、DNA的序列以及小分子在DNA中的构象具体分析。Cur不具有手性中心,因而忽略化合物Cur自身的影响 ADDIN EN.CITE ADDIN EN.CITE.DATA [25-29]。
图6为游离的CT-DNA以及CT-DNA和化合物Cur作用后的CD光谱。从图中可以看出:浓度为2×10-4mol/L的化合物Cur与CT-DNA作用3h后,CT-DNA CD谱的形状基本保持不变,无新峰出现,但245 nm负吸收峰和273 nm正吸收峰处的摩尔椭圆率明显降低,这种变化可能是由于化合物Cur插入CT-DNA的碱基对之间,使DNA由紧密的双螺旋态变为松散态,影响DNA碱基对之间π-π堆积作用,引起双螺旋链构象的变化。
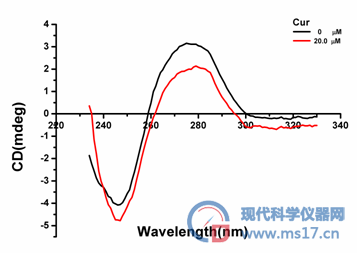
图6. Cur (2.0×10-4mol/L)对CT-DNA圆二色谱的影响
4. 结论
李克强总理在首届中国“互联网+”大学生创新创业大赛时做出重要批示,强调一定要“把创新创业教育融入人才培养”。“首医”培养创新型和创业型人才是以国家级实验教学示范中心为重要场所,实验教学就是最实用的实施载体。作为首都医科大学药学院药学专业实验课程的一部分,本实验的设置和内容安排集理论知识的学习和实践操作为一体,使学生知识技能、综合素质等方面都有所提高。通过讲解和自主操作的训练,学生基本掌握了样品的制备方法,能独立完成紫外- 可见分光光度计、荧光分光光度计和圆二色谱仪的操作过程,并能对数据进行基本解读和分析。光谱仪的引入,提高了药学专业实验的创新性和探索性,使学生能够初步体会科学研究的乐趣,初步了解充满挑战性的科研过程,为今后开展自主性的工作打下基础;同时能够熟练操作大型仪器,对于提高药学专业本科生的就业竞争实力有一定意义。
致谢
本论文是在2016年度首都医科大学校长基金(2016JYY44,2016JYZ06)、2016年度首都医科大学科研基金项目(2016ZR22)资助下完成的。感谢多肽及小分子药物北京市重点实验室和内源式预防药物教育部工程研究中心提供试验场地和仪器。
参考文献
[1] Palchaudhuri R, Hergenrother P J. DNA as a target for anticancer compounds: methods to determine the mode of binding and the mechanism of action [J]. Current opinion in biotechnology, 2007, 18(6): 497-503.
[2] Pindur U, Jansen M, Lemster T. Advances in DNA-ligands with groove binding, intercalating and/or alkylating activity: chemistry, DNA-binding and biology [J]. Current medicinal chemistry, 2005, 12(24): 2805-2847.
[3] Snyder R D. Assessment of atypical DNA intercalating agents in biological and in silico systems [J]. Mutation research, 2007, 623(1-2): 72-82.
[4] Snyder R D, Hendry L B. Toward a greater appreciation of noncovalent chemical/DNA interactions: application of biological and computational approaches [J]. Environmental and molecular mutagenesis, 2005, 45(2-3): 100-105.
[5] Strekowski L, Wilson B. Noncovalent interactions with DNA: an overview [J]. Mutation research, 2007, 623(1-2): 3-13.
[6] Agudelo D, Bourassa P, Bérubé G, Tajmir-Riahi H-A. Intercalation of antitumor drug doxorubicin and its analogue by DNA duplex: Structural features and biological implications [J]. International Journal of Biological Macromolecules, 2014, 66(144-150.
[7] Lei H, Wang X, Wu C. Early stage intercalation of doxorubicin to DNA fragments observed in molecular dynamics binding simulations [J]. Journal of Molecular Graphics and Modelling, 2012, 38(279-289.
[8] Shan L. 99mTc-Labeled doxorubicin [M]. Molecular Imaging and Contrast Agent Database (MICAD). Bethesda (MD); National Center for Biotechnology Information (US). 2004.
[9] Mukherjee A, Sasikala W D. Chapter One - Drug–DNA Intercalation: From Discovery to the Molecular Mechanism [M]//TATYANA K-C. Advances in Protein Chemistry and Structural Biology. Academic Press. 2013: 1-62.
[10] Rehman S U, Sarwar T, Husain M A, Ishqi H M, Tabish M. Studying non-covalent drug–DNA interactions [J]. Archives of Biochemistry and Biophysics, 2015, 576(49-60.
[11] Barcelo F, Barcelo I, Gavilanes F, Ferragut J A, Yanovich S, Gonzales-Ros J M. Interaction of anthracyclines with nucleotides and related compounds studied by spectroscopy [J]. Biochimica et Biophysica Acta (BBA) - General Subjects, 1986, 884(1): 172-181.
[12] Hovorka O, Šubr V, Větvička D, Kovář L, Strohalm J, Strohalm M, Benda A, Hof M, Ulbrich K, Říhová B. Spectral analysis of doxorubicin accumulation and the indirect quantification of its DNA intercalation [J]. European Journal of Pharmaceutics and Biopharmaceutics, 2010, 76(3): 514-524.
[13] Raman N, Selvan A, Sudharsan S. metallation of ethylenediamine based Schiff base with biologically active Cu(II), Ni(II) and Zn(II) ions: Synthesis, spectroscopic characterization, electrochemical behaviour, DNA binding, photonuclease activity and in vitro antimicrobial efficacy [J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2011, 79(5): 873-883.
[14] Rambabu A, Pradeep Kumar M, Tejaswi S, Vamsikrishna N, Shivaraj. DNA interaction, antimicrobial studies of newly synthesized copper (II) complexes with 2-amino-6-(trifluoromethoxy)benzothiazole Schiff base ligands [J]. Journal of photochemistry and photobiology B, Biology, 2016, 165(147-156.
[15] Sharma S, Yadav M, Gupta S P, Pandav K, Kumar S. Spectroscopic and structural studies on the interaction of an anticancer β–carboline alkaloid, harmine with GC and AT specific DNA oligonucleotides [J]. Chemico-Biological Interactions,
[16] Zianna A, Psomas G, Hatzidimitriou A, Lalia-Kantouri M. Ni(II) complexes with 2,2-dipyridylamine and salicylaldehydes: Synthesis, crystal structure and interaction with calf-thymus DNA and albumins [J]. Journal of inorganic biochemistry, 2016, 163(131-142.
[17] Selvakumar B, Rajendiran V, Uma Maheswari P, Stoeckli-Evans H, Palaniandavar M. Structures, spectra, and DNA-binding properties of mixed ligand copper(II) complexes of iminodiacetic acid: the novel role of diimine co-ligands on DNA conformation and hydrolytic and oxidative double strand DNA cleavage [J]. Journal of inorganic biochemistry, 2006, 100(3): 316-330.
[18] Wu J, Cui G, Zhao M, Cui C, Peng S. Novel N-(3-carboxyl-9-benzyl-carboline-1-yl)ethylamino acids: synthesis, anti-proliferation activity and two-step-course of intercalation with calf thymus DNA [J]. Molecular bioSystems, 2007, 3(12): 855-861.
[19] Zou X H, Ye B H, Li H, Zhang Q L, Chao H, Liu J G, Ji L N, Li X Y. The design of new molecular "light switches" for DNA [J]. Journal of biological inorganic chemistry : JBIC : a publication of the Society of Biological Inorganic Chemistry, 2001, 6(2): 143-150.
[20] 徐宏, 邓洪, 胡红雨, 刘建忠, 巢晖, 刘杰, 计亮年. 多吡啶钌(Ⅱ)配合物的合成及其与RNA相互作用的光谱学研究 [J]. 高等学校化学学报, 2003, 01): 25-27.
[21] Sari M A, Battioni J P, Dupre D, Mansuy D, Le Pecq J B. Interaction of cationic porphyrins with DNA: importance of the number and position of the charges and minimum structural requirements for intercalation [J]. Biochemistry, 1990, 29(17): 4205-4215.
[22] Sehlstedt U, Kim S K, Carter P, Goodisman J, Vollano J F, Norden B, Dabrowiak J C. Interaction of cationic porphyrins with DNA [J]. Biochemistry, 1994, 33(2): 417-426.
[23] Zupan K, Herenyi L, Toth K, Majer Z, Csik G. Binding of cationic porphyrin to isolated and encapsidated viral DNA analyzed by comprehensive spectroscopic methods [J]. Biochemistry, 2004, 43(28): 9151-9159.
[24] 刘振佳, 司伊康, 陈晓光. 圆二色谱测定技术在小分子化合物与DNA相互作用研究中的应用 [J]. 药学学报, 2010, 12): 1478-1483.
[25] Bishop G R, Chaires J B. Characterization of DNA structures by circular dichroism [J]. Current protocols in nucleic acid chemistry, 2003, Chapter 7(Unit 7.11.
[26] Chang Y M, Chen C K, Hou M H. Conformational changes in DNA upon ligand binding monitored by circular dichroism [J]. International journal of molecular sciences, 2012, 13(3): 3394-3413.
[27] Miyahara T, Nakatsuji H, Sugiyama H. Helical structure and circular dichroism spectra of DNA: a theoretical study [J]. The journal of physical chemistry A, 2013, 117(1): 42-55.
[28] Vorlickova M, Kejnovska I, Bednarova K, Renciuk D, Kypr J. Circular dichroism spectroscopy of DNA: from duplexes to quadruplexes [J]. Chirality, 2012, 24(9): 691-698.
[29] Zsila F. Apparent circular dichroism signature of stirring-oriented DNA and drug-DNA complexes [J]. Int J Biol Macromol, 2015, 72(1034-1040.
(本文由 现代科学仪器网 官方发布,请勿转载)

关注本网官方微信 随时订阅权威资讯

