高效液相色谱-质谱分析技术在甾醇类化合物检测中的应用
高效液相色谱-质谱分析技术在甾醇类化合物检测中的应用
赵起越* 赵红帅 刘保献
(北京市环境保护监测中心,北京 100048)
摘要 甾醇类化合物是一类具有生命活性的天然物质,与动植物及人类的生长发育密切相关,在医药、化妆品、食品、纺织等领域有广泛的应用。在甾醇类化合物众多的分析方法中,液相色谱-质谱分析技术独树一帜,应用越来越广。本文以液相色谱-质谱技术为线索,讨论了该技术用于甾醇类化合物检测分析的研究与应用,并展望了其发展前景,以期对未来进行甾醇类化合物的液相色谱-质谱分析提供参考。
关键词 液相色谱-质谱 甾醇类化合物 分析
中图分类号 O657.63
Application of High Performance Liquid Chromatography – Mass in the Detection of Sterols
Zhao Qiyue, Zhao Hongshuai, Liu Baoxian
(Beijing Municipal Environmental Monitoring Center, Beijing 100048)
Abstract Sterols is a kind of natural substances of life activity, closely related to living creatures, including human being. It has widely applied in the pharmaceutical, cosmetic, food, textile and other fields. Among numerous analytical methods of sterols, high performance liquid chromatography coupled with mass spectrometry(HPLC/MS), which being more used recently, stands apart from the crowd. Basing on HPLC/MS for clues, this article discusses the application of sterols determination, as well as its future development, provides references for the further application of HPLC/MS for sterol detection.
Keywords High performance liquid chromatography-mass spectrometry; Sterols; Analysis
甾醇是一类具有生物活性的物质,广泛存在于自然界中,与动植物的新陈代谢密切相关[1]-[2]。研究表明:有些甾醇可以降低血液中胆固醇含量,具有雌激素活性,能够抗癌及延缓衰老,可以治疗糖尿病、血胆脂醇过多等疾病,甚至对癌症的也有一定疗效[3]-[5],因此在食品、药品及化工等领域应用广泛。2000年,美国食品药品管理局(Food and Drug Administration,简称FDA)允许在人造黄油及沙拉中添加植物甾醇[6],我国卫生部也于十年后批准了添加β-谷甾醇及其甾醇酯的食品作为新资源食品[7]。然而,对烟草中的甾醇研究却发现烟草中的植物甾醇是产生致癌物苯并(a)芘的前体物质[8],卷烟烟气中61%的苯并[a]芘是由甾醇裂解产生的[8]-[9]。因此,确定样品中甾醇的结构并对其含量进行准确测定非常重要。
1.甾醇结构及其分析方法
甾醇的骨架结构为环戊氢化菲(甾核),通常由27 ~ 31个碳原子组成,C-3位上有烃基,C-10、C-13位上各有一个甲基,多数甾醇C-5位为双键,具体结构见下图。
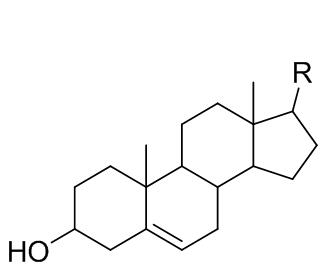
图1. 甾醇结构图
现已发现的甾醇有二百多种[11],常见的有胆甾醇、菜油甾醇、豆甾醇、菜籽甾醇、麦角甾醇及β-谷甾醇等几种,本文以胆甾醇、菜油甾醇、豆甾醇及β-谷甾醇为研究对象,讨论其液相色谱-质谱分析方法。
甾醇熔点较高,不溶于水,可溶于多种有机溶剂。甾醇一般存在于复杂的生物基体中,含量很低,必须经萃取分离,净化富集后分析。甾醇的分析方法很多,主要有化学分析法、薄层色谱法、气相色谱分析法及液相色谱分析法等。化学分析法(包括毛地黄皂甙法及酶法)及电化学分析法只能测定甾醇的总量,薄层色谱法灵敏度和重现性不好,GC直接进样法进样口温度过高,易造成目标化合物的分解,液相色谱与紫外(Ultraviolet,简称UV)及蒸发光散射检测器联用选择性差,灵敏度较低[12]-[15]。
气相色谱-质谱联用分析方法(Gas chromatography-mass spectrometry,简称GC/MS)是国内外通常采用的甾醇类化合物标准分析方法[16]-[18],该方法将样品进行提取后,使用衍生化试剂——通常为三氟双(三甲基硅烷基)乙酰胺(简称BSTFA)在一定条件下做硅烷化处理,所得产物热稳定性提高,挥发性增强,适于GC/MS测定[9],[19]-[20]。虽然GC/MS测定法灵敏度较高,但方法流程长,衍生试剂毒性大,检测时间长,重现性不好,有些甾醇在紫外线及氧存在时会降解,衍生反应损失较大[21]-[22]。
液相色谱-质谱联用方法无需衍生,检测快速、准确,是进行甾醇类物质含量测定的有效方法。
2.液相色谱-质谱联用技术(Liquid chromatography-mass spectrometry,简称LC-MS)
LC-MS是将液相色谱与质谱相结合进行样品检测的技术,该技术充分结合了高效液相色谱的高分离能力和质谱的强定性功能,使用保留时间与特征离子双重定性,提高了检测效率,改善了测定精度[23]-[25]。LC-MS适于分析难挥发、热不稳定的化合物,可以同时对多个成分进行定性定量,在目标化合物没有完全分离的情况下,依然可以进行分析,因此在某些情况下,可以简化样品的前处理过程[26]-[27]。LC-MS分析甾醇类化合物依据接口不同可分为两类,即使用电喷雾离子源(electrospray ionization,简称ESI)及使用大气压化学电离( atmospheric-pressure chemical ionization,简称APCI)两种[28]。
甾醇类化合物极性较弱,使用ESI的检测灵敏度不高,基体干扰较大,APCI适合分析比较稳定、分子量较小的化合物或非极性化合物。该电离方式一般只产生单电荷峰,可以进行较大流速的色谱分析[28]-[29]。段沅杏等使用ESI,在全扫描正、负离子电离模式下对甾醇类化合物进行了测定,结果表明,在负离子电离模式下,没有发现甾醇分子离子或特征离子峰。在正离子电离模式下,出现很弱的[M+H]+峰,[M+H-H2O]+峰略好。而使用APCI,在正离子模式下,甾醇化合物的[M+H-H2O]+峰较高,灵敏度比ESI提高两个量级以上,谱图更加简单,实际样品基体干扰小,分析准确度更高[30]。因为APCI方法分析甾醇类化合物比ESI灵敏度高,谱图上分子离子峰强度较大,碎片离子少,基体干扰少;ESI谱图上杂峰较多,实际样品基体干扰严重,痕量检测难度很大。所以,液相色谱-质谱法分析甾醇类化合物的文献,大多数采用APCI方法。
使用LC-MS测定甾醇类化合物的报道很多,将近期的一些报告汇总,列于表1中。
表1. LC-MS分析甾醇汇总表
|
年代 |
接口 |
样品 类型 |
目标化合物 |
方法描述 |
参考文献 |
|
2008 |
APCI |
善存标准物质 |
豆甾醇、谷甾醇、菜油甾醇及菜籽甾醇等 |
分别使用XTerra 及ACE C18色谱柱,流动相使用58%乙腈-水和90%甲醇-水,实验结果表明:使用这两种方法均不用衍生可以对豆甾醇、谷甾醇、菜油甾醇及菜籽甾醇等进行测定,其中ACE C18色谱柱、流动相90%甲醇-水的方法检测限更低。 |
31 |
|
2014 |
APCI |
烟叶 |
24种植物甾醇及甾醇酯 |
选择离子监测模式,使用无水流动相(乙腈与丙酮),回收率为80%--120%,检测限为0.9ng/mL—3ng/mL,该方法可用于烟叶中甾醇类化合物的检测。 |
32 |
|
2007 |
APCI |
橄榄油 |
胆甾醇、豆甾醇、ß-谷甾醇、二氢谷甾醇、岩藻甾醇、高根二醇 |
使用Atlantis C18色谱柱LC-MS分析了初榨、精炼橄榄油及橄榄果渣油中的甾醇类化合物,柱温30℃,流速0.5mL/min。 |
33 |
|
2005 |
APCI |
橄榄油 |
甘油二酯、三酯及甾醇类共计50多种化合物 |
配以橄榄油化学计量特征鉴定,于20min内分析了甘油二酯、三酯及甾醇类共计50多种化合物,利用逐步判定函数,在最强判断能力下对样品进行线性判定分析及分类、预测。预测成功率99% 。 |
34 |
|
2004 |
APCI |
海草 |
豆甾醇及菜油甾醇 |
应用Kromasil C18色谱柱,分别使用UV及MS检测器进行目标化合物的检测。由于样品中的豆甾醇及菜油甾醇保留时间重叠,LC-UV无法检测,而MS可以依赖选择离子反应对二者进行精确定量。 |
35 |
|
2012 |
APCI |
合成 纯品 |
胆甾醇、豆甾醇、ß-谷甾醇、菜油甾醇及菜籽甾醇 |
通过实验选取了C8色谱柱,电晕电流8μA,气化及干燥气温度均为350℃,谱图扫描质量范围为100-1000m/z。 |
36 |
|
2005 |
APCI |
Caco-2细胞 |
胆甾醇、谷甾醇及二氢谷甾醇 |
使用C8色谱柱、以豆甾醇做内标,样品基体效应很小。回收率为99.0±7.0%~109.8±5.0%,准确度为95%~106%,最低定量限的精密度低于9%。 |
37 |
|
2007 |
APCI |
食品谷物、芝麻、燕麦及花生等 |
胆甾醇、豆甾醇、ß-谷甾醇、菜油甾醇、羊毛甾醇、胆甾烷醇、谷甾醇、链甾醇、麦角甾醇及6-酮胆甾烷醇 |
国内采用液质联用方法分析食品中植物甾醇的首例报道。样品经超临界萃取后皂化,非皂化成分以石油醚提取、硅胶柱固相分离,正己烷-乙酸乙酯洗脱的部分通过BEH C18色谱柱,配以SIM检测,方法对10种甾醇类化合物的最低定量限为0.0076μg/L ~0.3674μg/L,日内及日间的测定精度分别小于5%及6%,回收率94%~107%。 |
11 |
LC与多级MS联用使母离子进行多次裂解,并由此揭示出复杂基质离子破裂过程中彼此的亲缘关系,提供更丰富的分子结构信息,使定性定量更加准确。除此以外,使用MS/MS的选择反应模式(Selected Reaction Monitoring,简称SRM)或多反应检测模式(Multi- Reaction Monitoring,简称MRM)可以提高测定信噪比,在复杂样品中可获得较高的灵敏度[38]。这方面的报道很多,总结列于表2。
表2. LC-MS/MS分析甾醇汇总表
|
年代 |
样品类型 |
目标 化合物 |
方法描述 |
参考文献 |
|
2001 |
酱油 |
谷甾醇及豆甾醇 |
建立了使用C8色谱柱的LC-UV及LC-MS/MS方法,LC-MS/MS离子源温度为130℃,雾化气400℃,电晕电流8.5μA,扫描范围为300—450u。研究表明:LC-UV只能依据目标化合物的保留时间检测,而对在同一保留时间出峰的菜油甾醇及豆甾醇无法识别;LC-MS/MS可以依据特征离子清晰地分辨出菜油甾醇及豆甾醇,从而大大提高了定量准确度。 |
39 |
|
2011 |
蚕幼虫组织 |
胆甾醇、豆甾醇、ß-谷甾醇、菜油甾醇、链甾醇、麦角甾醇、7-脱氢胆甾醇及3,4-13C胆甾醇 |
采用纯乙腈流动相,使用Pegasil ODS色谱柱,配合SRM进行检测,20min内可以检测8种化合物,定量限可达0.5 ng/mL—10ng/mL。方法简单、灵敏、特异性好,可用于皮克级甾醇类化合物的定量。 |
22 |
|
2015 |
血浆 |
胆甾醇、豆甾醇、谷甾醇、二氢谷甾醇及菜油甾醇 |
使用反相C18色谱柱,固相萃取处理血浆样品,内标法进行分析。研究还将血浆中的植物甾醇与每日摄入食物中的甾醇类化合物建立关系,以期通过饮食控制治疗高血脂症。 |
40 |
|
2013 |
多裂翘果菊 |
β-谷甾醇和豆甾醇 |
对多裂翘果菊不同采收期以及不同部位的β-谷甾醇和豆甾醇进行测定。样品以石油醚提取,BEH C18色谱柱分析,配以MRM检测,两种化合物回收率在93.45% --104.23%,相对标准偏差不高于7%。
|
42 |
|
|
烟叶 |
胆甾醇、豆甾醇、ß-谷甾醇、菜油甾醇、麦角甾醇 |
采用C18反相色谱柱,甲醇-水为流动相,在40℃下进行分析。5种不同的烟草当日分析精密度为0.77%~6.85%,日间精密度为1.69%~8.58%,回收率达90%以上。 |
41 |
LC/MS技术中的MS一般为四级杆质谱,如果换成飞行时间质谱(Time of Flight,简称TOF), 接口换成基体辅助激光解析离子化(Matrix-Assisted Laser Desorption Ionization,简称MALDI)类型,检测灵敏度还会提高。Ksouri WM等使用高效液相色谱与TOF联用测定中药Z. album幼苗提取物中包括甾醇在内的10种生命活性化合物,研究对二氯甲烷、正己烷及甲醇的提取物进行了考察,证实中药Z.album具有较强的抗氧化能力[43]。Calvano CD等使用固相微柱萃取及MALDI离子化LC,配以TOFMS对特级初榨橄榄油及榛子油中包含甾醇的极性成分进行简便快速的定量。测定发现特级初榨橄榄油中混有5%的榛子油,并检出了橄榄油中掺入的榛子油特征化合物-——溶血磷脂胆碱[44]。
3.展望
随着人民生活水平的提高,甾醇类化合物在食品、医药及化工等领域的应用越来越广,其检测技术的发展也非常活跃。传统的GC/MS法需要衍生,复杂而耗时, LC/MS简化了样品的前处理步骤,节省了大量试剂和时间,避免了前处理带来的误差,可操作性更强。LC-MS/MS方法可以实现复杂基体中痕量甾醇类化合物的准确定性定量,近些年,应用该技术分析甾醇类化合物的研究愈来愈多,分析化合物的种类也逐渐增加。
生物学代谢机制和调控激素的作用使得过程监控和分析变得重要,因此,发展原位、在线的分析技术将成为LC/MS检测方法未来努力的方向。固相萃取等前处理技术与先进的LC/MS及LC-MS/MS相结合,可以开发现场、原位、实时的甾醇类化合物测定方法,从而更好地适应食品、环境、化工等领域分析发展的需求。
参考文献
[1] Naumoska K, Vovk I, Analysis of triterpenoids and phytosterols in vegetables by thin-layer chromatography coupled to tandem mass spectrometry, J. Chromatography A, 2015, 1381: 229–238
[2] Huang LY, Cao YY, Xu H, et. al., Separation and purification of ergosterol an stigmasterol in Anoectochilus roxburghii (wall) Lindl by high – speed counter – current chromatography, J. Sep. Sci., 2011, 34: 385-392
[3]Suttiarporn P , Chumpolsri W, Mahatheeranont S, et. al., Structures of Phytosterols and Triterpenoids with Potential Anti-Cancer Activity in Bran of Black Non-Glutinous Rice, Nutrients 2015, 7, 1672-1687
[4] Cleghorn CL, Skeaff CM, Mann J, et al., Plant sterol – enriched spread enhances the cholesterol – lowering potential of a fat- reduced diet, European Journal of Clinical Nutrition, 2003,57:170-176
[5] Boldizsár I, Füzfai Z, Perl IM, Characterization of the endogenous enzymatic hydrolyses of Petroselinum crispum glycosides: Determined by chromatography upon their sugar and flavonoid products, J. Chromatography A, 2013,1293: 100– 106
[6] Hicks KB, Moreau RA. Phytosterols and phytostanols functional food: cholesterol busters, Food Technol., 2001, 55: 63-67
[7] 邱丰艳,丁力,曹红云,高效液相色谱法测定油脂中β-谷甾醇的含量,中国油脂,2014,39(7):91-95
[8] Britt PF, Buchanan III AC, Kidder MK, et. al., Influence of steroid structure on the pyrolytic formation of polycyclic aromatic hydrocarbons, Journal of analytical and applied pyrolysis, 2003, 66(1): 71-95
[9] 向章敏,张婕,蔡凯,衍生化气相色谱质谱联用法同时测定烟叶多种植物甾醇,光谱实验室,2011,28(5):2536-2540
[10] 尹健,魏万之,钟科军,气相色谱测定烟草中的β-谷甾醇, 湖南大学学报(自然科学版), 2000,27(6): 22-27
[11] Lu BY, Zhang Y, Wu XQ et. al., Separation and determination of diversiform phytosterols in food materials using supercritical carbon dioxide extraction and ultraperformance liquid chromatography-atmospheric pressure chemical ionization- mass spectrometry, Analytica Chimica Acta, 2007, 588: 50-63
[12] Cimpoiu C, Hosu A, Hodisan S, Analysis of some steroids by thin – layer chromatography using optimum mobile phases, Journal of pharmaceutical and biomedical analysis, 2006, 41(2): 633-637
[13] 张丽霞,毕艳兰,张康逸,植物甾醇与甾醇酯的分离分析方法研究,粮油加工与食品机械,2006,2:53-55
[14] 鲍忠定,许荣年,张颂红,毛细管气相色谱法测定油中植物甾醇和胆甾醇,分析化学,2002,30(12):1490-1493
[15]张媛媛,吕双双,李书国,电化学分析法快速测定粮油食品中的总植物甾醇含量,现代食品科技,2015,31(5):297-302
[16] 烟草及烟草制品麦角甾醇的测定 气相色谱-质谱联用法(YC/T471-2013)
[17] 动植物油脂.甾醇和总甾醇含量的测定.气相色谱法DIN EN ISO12228-1999
[18] 动植物油脂.甾醇和总甾醇含量的测定.气相色谱法GB/T-25223-2010
[19] 钟巧莉,朱志鑫,吴惠勤,等,衍生化气相色谱-质谱法测定植物油中植物甾醇,分析测试学报,2012,31(8):987-991
[20] 繆妙,严小军,徐继林,等,海洋微藻中C3羟基甾醇TMS衍生物EI源质谱规律研究,质谱学报,2009,20(3):139-147
[21] Jaffé R, Rushdi AI, Medeiros PM, et. al., Natural product biomarkers as indicators of sources and transport of sedimentary organic matter in a subtropical river, Chemosphere, 2006, 64: 1870-1884
[22] Igarashi F, Hikiba J, Ogihara MH, et. al., A highly specific and sensitive quantification analysis of the sterols in silkworm larvae by high performance liquid chromatography – atmospheric pressure chemical ionization – tandem mass spectrometry, Analytical Biochemistry, 2011, 419: 123-132
[23] 王婵,孙兴权,吴运高,等,液质联用技术在生物毒素食品安全检测分析中的应用,食品安全质量检测学报,2015,6(1):3-9
[24] Stapels MD, Barofoky DF, Complementary Use of MALDI and ESI for the HPLC-MS/MS Analysis of DNA-Binding Proteins, Anal. Chem., 2004, 76: 5423-5430
[25]孟凡飞,田葆萍,张光友,等,液质联用技术在水质分析中的应用研究进展,职业与健康,2014,30(16):2344-2345,2348
[26] 赵起越,赵红帅,刘保献,等,直接进样-高效液相色谱-串联质谱法测定地表水中9种微囊藻毒素,分析化学,2015,43(4):594-598
[27] 赵起越,赵红帅,刘保献,等,大气颗粒物中左旋葡聚糖及其异构体的质谱分析,分析仪器,2014,6:1-7
[28] Lloyd R. Snyder, Joseph J. Kirkland,John W. Dolan, 液相色谱技术导论,第3版, 人民卫生出版社,[M], 陈小明,唐亚妍翻译。2012, 7:91
[29] 方晓明,张社,液相色谱-质谱联用技术新进展及应用, 现代仪器, 2002, 3: 1-5
[30] 段沅杏,张涛,陈进雄,等,电喷雾质谱法与大气压化学电离质谱法分析烟叶中植物甾醇的比较,应用化工,2013,42(5):954-957
[31] Bedner M, Schantz MM, Sander LC, et. al., Development of liquid chromatographic methods for the determination of phytosterols in Standard Reference Materials containing saw palmetto, J. Chromatography A, 2008, 1192: 74-80
[32] Ishida N, A method for simultaneous analysis of phytosterols and phytosterol esters in tobacco leaves using non aqueous reversed phase chromatography and atmospheric pressure chemical ionization mass spectrometry detector, J. Chromatography A, 2014, 1340: 99-108
[33] Cañabate-Díaz B, Carretero AS, Fernández- Gutiérrez A, et. al., Separation and determination of sterol in olive oil by HPLC-MS, Food Chemistry, 2007, 102: 593-598
[34] Nagy K, Bongiorno D, Avellone G, et. al., High performance liquid chromatography – mass spectrometry based chemometric characterization of olive oils, Journal of Chromatography A, 2005, 1078: 90-97
[35] Sánchez-Machado DI, López-Hernández J, Paseiro-Losada P, et. al., An HPLC method for the quantification of sterols in edible seaweeds, Biomedical Chromatography, 2004, 18: 183-190
[36] Madawala SRP, Andersson RE, Jastrebova JA, et. al., Phytosterol and α-Lipoic Acid Conjugates : Synthesis, Free Radical Scavenging Capacity and RP-LC-MS-APCI Analysis, Pol. J. Food Nutr. Sci., 2012, 62(3): 159-169
[37] Palmgrén JJ, Töyräs, A, Mauriala T, et. al., Quantitative determination of cholesterol, sitosterol and sitostanol in cultured Caco-2 cells by liquid chromatography – atmospheric pressure chemical ionization mass spectrometry, J. Chromatography B, 2005, 821: 144-152
[38]唐瑰宝,陈楠,潘馨,等,液质联用技术在黄酮类化合物研究中的应用,海峡药学,2011,23(12):7-9
[39] Careri M, Elviri L, Mangia A, Liquid chromatography –UV determination and liquid chromatography – atmospheric pressure chemical ionization mass spectrometric characterization of sitosterol and stigmasterol in soybean oil, J. Chromatography A, 2001, 935: 249-257
[40] Mateo-Gallego R, Baila-Rueda L, Mouratidou T, et. al., Serum plant sterol as surrogate markers of dietary compliance in familial dyslipidemias, Clinical Nutrition, 2015, 34: 490-495
[41]《烟草及烟草制品 游离甾醇的测定 高效液相色谱-串联质谱法》技术报告,云南烟草科学研究院,2013
[42] 侯彩婷,王瑞华,邹昀员,等,UPLC-MS/MS法测定多裂翘果菊中植物甾醇的含量,食品科学,2013,34(14):301-305
[43] Ksouri WM, Medini F, Mkadmini K, et. al., LC–ESI-TOF–MS identification of bioactive secondary metabolites involved in the antioxidant, anti-inflammatory and anticancer activities of the edible halophyte Zygophyllum album Desf, Food Chemistry, 2013, 139: 1073–1080
[44] Calvano CD, Aresta A, Zambonin CG, Detection of hazelnut oil in extra-virgin olive oil by analysis of polar components by micro-solid phase extraction based on hydrophilic liquid chromatography and MALDI-TOF mass spectrometry, J. Mass. Spectrom., 2010, 45: 981–988

关注本网官方微信 随时订阅权威资讯

