唾液α-淀粉酶快速检测仪器研发及应用
唾液α-淀粉酶快速检测仪器研发及应用
黄晶晶1,陈利琴2,王羽1,沈康维1,李晨1,康学军1*
(1东南大学学习科学研究中心,儿童发展与学习科学教育部重点实验室,南京 210096;2 天津医科大学公共卫生学院,天津 300070)
摘 要 基于碘-淀粉法并利用流动注射技术开发了一种能在线快速检测唾液α-淀粉酶的检测仪,主要由流路动力部分A、反应室控制部分B和可见分光检测三部分组成。该仪器携带方便,操作简单,低成本、低耗能,在110s内即可完成一个样本的唾液α-淀粉酶测试。该仪器可实现自动化操作,精密度高,能较好的监测到应激过程,经人体运动应激实验和考试焦虑应激实验的样本检测试用,可以满足人群实验要求。
关键词 唾液α-淀粉酶;流动注射分析;应激
中图分类号 O657
Development of On-line Monitoring Instrument for Determination of S alivary α-amylase
Huang Jing-Jing1, Chen Li-Qin2, Wang Yu1, Shen Kang-Wei1, Li Chen1, Kang Xue-Jun1*
(1 Research Center for Learning Science, Southeast University,Key Laboratory of Child Development and Learning Science of Ministry of Education, Southeast University, Nanjing 210096;2 School of public health, Tianjin Medical University, Tianjin 300070)
Abstract A monitoring instrument was developed based on iodine-starch reaction and flow injection technique for the on-line rapid determination of salivary α-amylase, which mainly consists of flow path driver, control part of reaction chamber and visible spectrophotometry detection. By using this flow injection- spectrophotometric analysis system, the detection time needed for a sample is only 110s. The instrument can run automatically with a high precision, low cost and low energy-consumption. The developed instrument was successfully applied to the detection of salivary samples from volunteers recruited for an exercise stress test and an exam anxiety stress test. The stress process can be monitored by this instrument with good reproducibility.
Key words Salivary α- amylase; Flow injection analysis; Visible spectrophotometric analysis; Stress
现代社会人们每天都面对来自各方面的压力,而压力过大往往会诱发多种心理疾病,如诱发神经官能症、抑郁障碍等疾病[1]。压力对健康、行为以及对工作效率的影响已成为国际上重要的职业卫生问题之一,评价压力程度具有着重要的意义,当下进行心理压力评估的方法大部分采用心理学问卷,属于非客观的心理学范畴,测试结果受被试配合度影响较大。近年来多个实验证明唾液α-淀粉酶(SAA)可以作为交感神经系统激活的标志,能够响应心理应激和躯体应激[2]。当精神压力增大时,SAA水平会急剧升高[3-4],因此检测SAA的水平,了解人的精神压力状况,以便及时进行身心调节就显得尤为重要。目前可以用于淀粉酶测定的方法据统计已经有200种之多[5],但尚没有一种可以完全符合国际临床化学联合会(IFCC)的要求。这些方法可归纳为二类:天然淀粉底物方法和分子组成确定底物方法。
目前临床上用温斯罗(Winslow)氏法和和苏木杰(Someyvi)氏法[6]来测定SAA的含量,虽然操
作简单,但温斯罗氏法需使用Beckman SYNCHRON CX7 等大型的生化分析仪器,并在结果上存在着不精确和所需时间较长,每测定一次至少要50分钟,影响及时诊断,而苏木杰氏法在滴定时需留心观察终点,稍一疏忽,即不易准确,尤其在晚间灯光下,更不容易观察,每作一次试验,最少需要30分钟,这两种方法都不适用于大批量的人群检测,因此研制一种能检测唾液α-淀粉酶的低成本、操作简单、快速检测的仪器是非常有必要的。现今国外开发用于检测唾液α-淀粉酶活性的便携式仪器主要是以生物传感器为主。比如Masaki Yamaguchi等课题组[7]在生物活性材料的基础上开发了唾液α-淀粉酶生物传感器,该机制是利用淀粉在底物浓度过量时能在SAA的催化下产生麦芽糖,而涂在电极表面上的α-糖苷酶将产生的麦芽糖催化氧化产生电流信号来定量测定SAA的活性。Attia.MS等课题组[8]在淀粉底物与酶反应的基础上利用溶胶-凝胶和纳米技术开发了用以评估SAA活性的光学传感器。生物传感器检测仪相对于大型仪器来说,对唾液样本需求量小,携带方便,但是将底物膜片修饰到SAA生物传感器上的操作复杂、系统稳定性不够、线性范围窄,干扰因素多,要满足实际应用需要还有待完善。
流动注射分析(Flow Injection Analysis,FIA),是由丹麦技术大学的J.Ruzicka 和E.H.Hansen于1975年提出了的新概念,即在热力学非平衡条件下,在液流中重现地处理试样或试剂区带的定量流动分析技术。它与其它分析技术相结合极大地推动了自动化分析和仪器的发展,成为一门新型的微量、高速和自动化的分析技术。流动注射分析发展迅速,它已被广泛应用于很多分析领域,被认为是获得数据的一个关键实时和有效的工具。目前已经有不少与FIA技术相结合的方法报道了SAA的检测[9-12]。本研究小组利用流动注射技术开发了一种能在线快速检测SAA的仪器,该仪器测定单个样本的周期仅为110s,可以实现自动化操作,精密度高,能较好的监测到人体应激过程,人体运动应激实验和考试焦虑应激实验的样本检测结果表明可以满足人群实验要求。
1 仪器工作原理
流动注射分析是一种管道化的连续流动分析法,主要包括试样溶液注入载流、试样溶液与载流的混合和反应(试样的分散和反应)、试样溶液随载流恒速地流进检测器被检测三个过程。即把一定体积的试样溶液注入到一个流动着的非空气间隔的试剂溶液载流中,被注入的试样溶液(或水)流入反应盘管,形成一个区域,并与载流中的试剂混合、反应,再进入到分光光度检测器进行测定分析及记录。唾液α-淀粉酶快速检测仪系统流路图如图1所示。
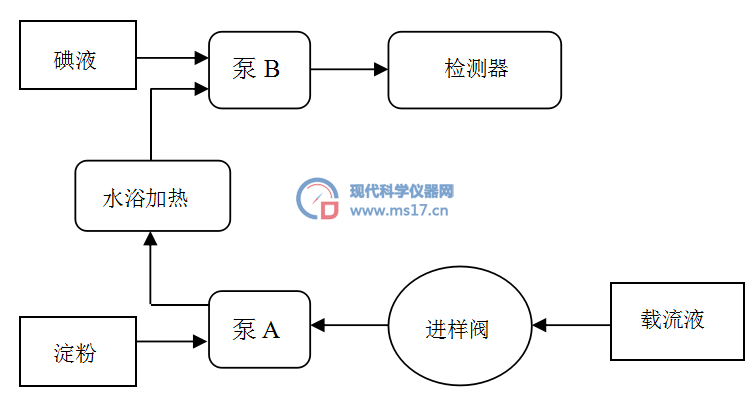
图1 唾液α-淀粉酶快速检测仪系统流路图
如图1所示,在泵A的带动下,载流液即去离子水通过进样阀将唾液样品与淀粉溶液进行混合并通过一系列软管在37℃水浴环境中加热,然后在泵B的带动下,加热后的唾液样本与淀粉及去离子水的混合物再与碘液进行混合进行显色反应,然后进入检测器中检验。
2 仪器各个部分结构
(1)仪器电器部分主要有流路动力部分A和反应室控制部分B组成;流路动力部分A有由两个蠕动泵b提供动力,每个蠕动泵都由独立的脉冲宽度调制(PWM)无极调速器a进行控制,用于控制流路中溶液的流速;反应室控制部分B由比例-积分-微分控制(PID)温控器d精确控制反应室中水的温度,循环水泵e由循环时间继电器f控制,用于周期性地对反应室c内的水进行内部循环,促进反应室内水温的控制。如图2所示。
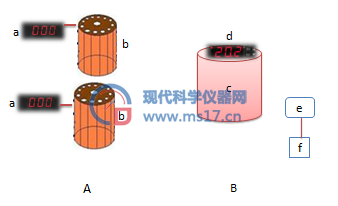
图2 仪器电器图
(2)反应室为密封的小型隔热容器,既能减小仪器体积,同时有效提高温控效率,密封设计使仪器在搬运时防止反应室内的水溢出,提高仪器的便携性。循环水泵通过进水和出水两路实现反应室内水的流动,液位计f与反应室相连,实时反映反应室内的水量,在水量不足时能及时提醒添加;反应室的进水孔g与液位计f相连,水经液位计f加入反应室中,当加满时,水会从出水孔h溢出,所以加水时需使用配套的外接管路,防止溢出的水流到仪器外;进水孔g和出水孔h配有独立的塞子,用于在搬运时防止反应室内的水溢出。反应室的流路、分析部分流路及实物外观图分别如下图3、4和5所示。
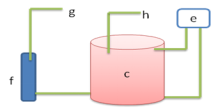
图3反应室流路图
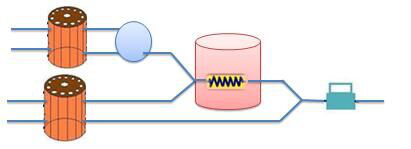
图4分析部分流路图

图5仪器实物外观图
3优势所在
(1)仪器设备结构简单。采用的管道多数是由聚乙烯、聚四氟乙烯等材料制成的,具有良好的耐腐蚀性能。
(2)易于自动连续分析。该仪器把流动注射技术与分光光度法结合并将分析流程管道化,除去了原来分析中大量而繁琐的手工操作,并由间歇式流程过渡到连续自动分析,避免了在操作中人为的差错。
(3)试样用量较少。试剂的用量每次仅需数十微升至数百微升,节省了试剂,降低了费用。
(4)分析速度较快,精密度好。由于反应不需要达到平衡后测定,因而分析频率很高,测定单个样本的SAA水平的周期仅为110s。注射分析过程的各种条件可以得到较严格的控制,因此提高了分析的精密度。
4实验部分
4.1仪器与试剂
流动注射进样器(自带控温系统)(苏州东奇生物科技有限公司),723可见分光光度计(上海菁华科技仪器有限公司),TGL-16C离心机(上海安亭科学仪器厂)。
α-淀粉酶标准品(购自北京索莱宝科技有限公司,酶活力3700 u/g),碘液:碘化钾、碘(分析纯,上海申博化工有限公司),实验用水为二次去离子水。
4.2溶液配制
精密称取酶标准品加水配制成10mg/mL的溶液,再依次稀释成0 µg/mL、5 µg/mL、12.5 µg/mL、20 µg/mL、50 µg/mL的酶系列工作溶液。精密称取6.5 g碘与17.5 g碘化钾,加水定容至1000 mL,配制成含碘50 mmol/L的碘液。
4.3 样本采集和处理
(1)考试焦虑应激实验唾液采集:采用考试焦虑量表(TAI)和状态特质焦虑量表(STAI)筛选出高考试焦虑组被试10名,低考试焦虑组被试10名。被试的平均年龄为23.43±1.36岁;实验采用情绪负启动范式,语义判断的情绪负启动任务,对个体进行单独测试;采集实验前30 min、实验结束、以及实验结束休息10 min的唾液。采集方式均为被试用清水漱口后,直接向试管中吐入唾液,约0.5 ml左右即可。
(2)运动应激实验唾液采集:以20名本校大学生为被试,平均年龄为22.35±1.21岁;采集运动前10分钟、运动结束以及结束后10分钟的唾液。采集方式均为被试用清水漱口后,直接向试管中吐入唾液,约0.5 ml左右即可。
(3)唾液处理:将唾液10000 转/分离心30 s,精密量取10 µL,稀释至10 mL,混匀,即得到待测溶液,放置于4℃冰箱冷藏待用。
4.4 检测步骤
(1)空白水样;得到的吸光度值为A。
(2)标准α-淀粉酶液:0.1mg/mL,0.2mg/mL,0.5 mg/mL,0.75mg/mL,1.0mg/mL,2.0 mg/mL;当试样流经管路与淀粉反应后得到的吸光度值为A,以ΔA(ΔA= A0-A)对α-淀粉酶系列标准溶液做工作曲线。
(3)实际唾液检测;根据工作曲线计算其唾液α-淀粉酶浓度。
5结果与讨论
5.1 流路设计优化
在流路设计过程中考虑到碘液会影响酶促反应,所以将碘液安排在酶淀粉反应之后进入流路与淀粉接触反应,通过另一个三通将两路流路汇流后带至检测器检测。而实验中需要控制量的淀粉液和试样都通过多通道进样阀定量进入流路,被载流水带至反应盘管先反应一段时间。
5.2实验条件优化
由于碘淀粉比色法的实验已经研究的比较多[13-14],实验条件比较成熟,所以实验开始阶段选用文献中报道的试剂浓度进行初试。实验发现淀粉溶液在0.8 mg/mL的浓度最为合适。碘液按文献中报道的50 mmol/L配制经实验验证是可行的。此外,因为淀粉酶的酶促反应受温度影响,所以需要控制反应温度,依然选择文献中报道的37℃作为此孵育反应温度。酶促反应需要孵育一段时间,所以最终选择反应30s作为最佳停留时间。
5.3 线性与精密度
在优化条件下测得工作曲线经数据处理后得到线性方程为:ΔA = 0.02C-0.027,r = 0.9987。结果表明:当α-淀粉酶的浓度在0~55 µg/mL范围内,具有较好的线性关系。同时做回收率实验,回收率在96.2-103.5%之间,所有RSD值均小于5.0%。
5.4 酶活力单位转换
本方法中的SAA的浓度是通过标准酶标准曲线得到的,而实验最终结果需要以酶活力的形式标出,所以需要将浓度单位与活力单位进行转化。虽然所购买的酶标准品标注了酶活力,但是很难保证酶活力不会受到环境、贮藏条件等影响而有所变化,所以在本方法中采用给酶标液的酶活力下定义的方式,每次实验前测试一下酶标液的活力,再用来对照唾液样品的酶活力。
酶活力单位定义:1mL酶液在37℃保温30分钟催化10 mg淀粉为一个单位,(U/mL)
酶活力测试条件:2mL(1.6 mg/mL)淀粉溶液,加酶标液(0.1 mg/mL)10 µL,37℃反应10分钟,加碘液(50 mmol/L)1mL,加水定容至25 mL,660 nm处测试吸光度值。
计算公式: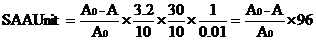
5.5应激实验
为验证所建方法能否监测应激反应过程,故设计了跑步运动应激和考试应激这两个实验来测试。
5.5.1运动应激实验结果
通过采集20名大学生被试运动前10分钟、运动结束以及结束后10分钟的唾液,将唾液离心稀释后用所建方法检测,结果见图6。最后将由线性方程得到的浓度结果再换算成活力单位。从图6可以看出唾液α-淀粉酶在应激过程中活力快速升高,应激结束后又会快速恢复到原先水平,这与国外研究文献中[15]的报道是一致的,说明本文所建立的流动注射光度法能够测定唾液中α-淀粉酶的活力,能够为应激实验研究提供研究手段和支持。
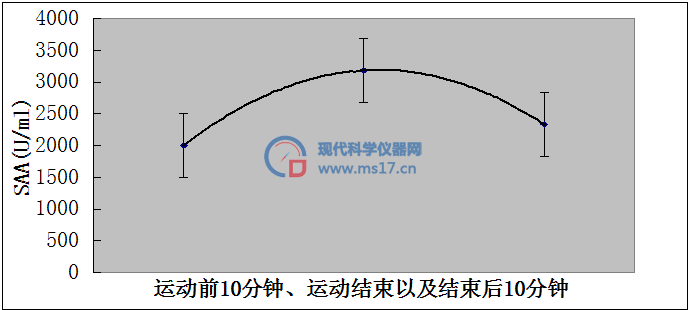
图6运动应激实验监测结果
5.5.2考试应激实验结果
通过采集考试高焦虑组和低焦虑组各10名被试实验前30 min、实验结束、以及实验结束休息10 min的唾液,结果见图7。从图7可以看出低焦虑组的被试唾液α-淀粉酶可以在应激事件之后较快的恢复到原有水平,而高焦虑组的被试恢复较慢,该实验结果同样能说明本文所建立的流动注射光度法能够测定唾液中α-淀粉酶的活力,能够为应激实验研究提供研究手段和支持。
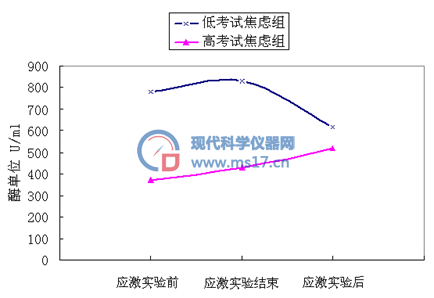
图7考试焦虑应激实验监测结果
6结论
本文利用碘-淀粉法结合流动注射技术构建现场快速测试唾液α-淀粉酶活性的测试仪器,验证该酶活性作为心理应激压力分析的无创快捷检测的可能性。该仪器测定一个样本的周期仅为110 s,可以实现自动化操作,精密度高,其工作性能稳定,能连续工作数日,操作简单方便,RSD值控制在5.0%内,可用个体或人群唾液α-淀粉酶的监测。该生化分析的方式使得心理应激压力的分析有了客观的数据指标。该仪器检测具有无创、快捷、低成本的特性,在评价人体压力应激反应状态方面有很大的用途,既可用于青少年学习压力和情绪能力评估,也可结合适当的应激实验用于特殊职业人群筛选评价,以及疲劳监测等应用。
致谢
本项目由东南大学儿童发展与学习科学教育部重点实验室开放基金(CDLS-2015-02),江苏省普通高校研究生科研创新计划(KYZZ_0070,SJZZ_0026)和天津医科大学科学基金 (
2012KYM11) 资助。
参考文献
[1] 谭清华,李留成,飞行人员神经精神疾病的分析,中华航空航天医学杂志 2002,13 (4):259-260
[2] Natera U M, Rohlederb N, Gaaba J, et al. Human salivary alpha-amylase reactivity in a psychosocial stress paradigm. International Journal of Psychophysiology [J], 2005,55: 333- 342
[3] Nater U M, Rohleder N, Gaab J et a1. Int J Psychophysiol,2005,55(3): 333
[4] Takai N, Yamaguchi M, Aragaki T et a1. Ann N Y Acad Sci, 2007,1098: 510
[5] Geng S M, Bai ZR, Yuan J C. Discussion on difficulty to standardize of Amylase determination method. China Practical Medicine [J], 2009,4: 206-207
[6] Allwood M A, Handwerger K, Kivlighan KT, et al. Direct and moderating links of salivary alpha-amylase and cortisol stress-reactivity to youth behavioral and emotional adjustment [J] Biological Psychology, 2011,88( 1): 57-64.
[7] Masaki Yamaguchi, Masashi Kanemaru. Flow-injection-type biosensor system for salivary amylase activity, Biosensors and Bioelectronics, 2003,18: 835-840
[8] Attia, MSZoulghena, H, A new nano-optical sensor thin film cadmium sulfide doped in sol-gel matrix for assessment of alpha-amylase activity in human saliva, 2014, 139 (4): 793-800
[9] Hansen P W. Determination of fungal α-amylase by flow injection analysis. Anal. Chim. Acta [J], 1984, 158: 375
[10] Schindler R, Lendl B, Kellner R. Simultaneous determination of a-amylase and amyloglucosidase activities using flow injection analysis with fourier transform infrared spectroscopic detection and partial least-squares data treatment. Anal. Chim. Acta [J],1998, 366: 35
[11] Van Staden J F, Mulaudzi L V. Flow injection spectrophotometric assay of a-amylase activity. Anal. Chim. Acta [J], 2000, 421: 19-25
[12] Yamaguchi M, Kanemaru M, Kanemori T, et al. Flow-injection-type biosensor system for salivary amylase activity. Biosensors and Bioelectronics [J], 2003, 18: 835-840
[13] Sun N, Zhang Y S, Zhang W H, et al. An improvement and application of starch iodine colorimetry for amylase. Heilongjiang Medical Journal [J], 1993, 10: 42-43
[14] Yuan J F. Rapid colorimetric method for determination of amylase. Medical Journal of Communications [J], 1998, 12:255
[15] Rohleder N, Nater, U M, Wolf J M, et al. Psychosocial stress-induced activation of salivary alpha amylase: an indicator of sympathetic activity? Ann. NYAcad. Sci [J], 2004, 10(32): 258-263

关注本网官方微信 随时订阅权威资讯

