建立基于分析纯试剂的AFT的液质检测法
建立基于分析纯试剂的AFT的液质检测法
李晓,徐延昭*
(中国食品药品检定研究院,北京100050)
摘 要 目的:比较国产分析纯和进口色谱纯甲醇在LC-MS方法分析AFT中的效果。方法:在分别采用国产分析纯和进口色谱纯甲醇的条件下,利用LC-MS方法,定量四种AFT。结论:四种AFT的质核比的实验结果和理论值偏差均在3.5 ppb以内,具有良好的质量精度;四种AFT可被基线分离;采用国产分析纯试剂测试四种AFT的提取离子色谱图可与采用进口色谱纯甲醇取得完全相同的峰形;四种AFT在采用色谱纯甲醇时的RSD为6%、2%、1%、4%,国产分析纯为4%、1%、1%、1%。采用高分辨质谱定量四种AFT的时,两种甲醇在分析过程中无可观察的差别,故可将国产分析纯甲醇作为流动相使用。因AFT是食品和中药材都要检测的常规项目,检验量大,因此本文结果可帮助实验人员显著降低检测成本,节省国家经费。
关键词 甲醇,黄曲霉毒素,液质联用,节省成本
中图分类号 TS207
Establishment of AFT Detection Method of LC-MS based on Domestic Analysis Reagent
Li Xiao, Xu Yanzhao *
(National Institutes for food and drug Control, BeiJing 100050, China)
Abstract Objective: Comparing domestic analysis pure and imported pure methanol in LC-MS methods to analyze aflatoxin. Methods: Using analyzed pure and imported pure methanol respectively, four aflatoxins quantitative were detected by the method of LC-MS. Conclusion:Four aflatoxins nucleo ratio of the experimental results and the theoretical value deviation were within 3.5 ppb, with good quality precision. Four AFT can be baseline separation. The chromatograms of four AFT were tested by domestic analysis reagent, it can achieve the same peak shape in keeping with imported chromatographic pure methanol; For four kinds of AFT two kinds of methanol experiment were used, when using pure methanol chromatographic four toxins RSD were 6%, 2%, 1% and 6% respectively, and analysis of domestic pure methanol was 4%, 4%, 1% and 1%.The experimental results showed that in full scan mode with high resolution mass spectrometry quantitative four aflatoxins, two kinds of methanol in the process of analysis with no observed difference, so we can use the domestic analysis of pure methanol as mobile phase. Due to aspergillus flavus toxin regular project of food and traditional Chinese medicinal materials testing, inspection quantity is big, therefore in this paper, the results can help the experimenter significantly reduce test cost, save the national test.
Key words: Methanol; Aflatoxin; LC-MS; Cost savings
黄曲霉毒素是在食品或中药材发霉过程中产生的致癌毒素,是食品的必检项目[1-3]。2015版药典也在中药材检测项目中增加了对黄曲霉毒素的要求。常见的检测方法有薄层色谱法[4-5]、胶体金试纸法[6-7]、酶联免疫法或免疫传感器法[8-10],荧光光谱法[11]液相色谱或液质联用法[12-13]等,其中液质联用方法由于检测限低,抗基质干扰能力强,是实验室中广泛采用的精确测定黄曲霉毒素的方法之一。在日常检测工作中,实验人员普遍认为,作为一种高灵敏度的检测方法,液质联用法需要使用高纯度进口溶剂作为流动相以保证实验的灵敏度和准确性。但是由于进口溶剂价格昂贵且采购周期长,不仅需要花费更多的经费,而且如果遇到一些不可抗力的原因(如海关清关速度限制,海运陆运意外等)致使溶剂断货的话更会严重影响日常检测工作的开展。
为了验证国产分析纯溶剂是否能够在某些项目中取代进口试剂,从而达到节省检测成本,缩短采购周期的目的。本文对比了进口色谱纯甲醇和国产分析纯甲醇在检测粮食中几种黄曲霉毒素实验中的影响。结果表明,两种甲醇对待测物的质谱图质量和定量结果都没有明显的差别。这说明在使用LC-MS分析黄曲霉毒素时,用国产分析纯甲醇代替进口色谱纯甲醇,可以得到满足日常检测要求的结果。
1 材料与方法
1.1 样品
实验用黄曲霉毒素标准品(黄曲霉毒素B1(AFB1)、黄曲霉毒素B2(AFB2)、黄曲霉毒素G1(AFG1)、黄曲霉毒素G2(AFG2)),购自美国Sigma公司。
1.2 主要仪器及试剂
乙酸铵、甲酸、乙酸,购自美国Sigma公司;甲醇、乙腈(色谱纯):购自美国默克公司;0.2 mm PTFE膜针头过滤器:美国PALL公司。国产甲醇(分析纯):北京试剂公司;实验用水为18.2兆欧电导水。四极杆/静电场轨道阱高分辨质谱仪Q-Exactive (购自ThermoFisher Scientific公司);UltiMate 3000快速液相色谱仪(购自ThermoFisher Scientific公司);3-30K离心机(购自美国Sigma公司);GT10-1 高速台式离心机(购自北京时代北利离心机有限公司);Roto-Shake Genie 多用途旋转摇床(购自美国Scientific Industries公司);Milli-Q超纯水纯化系统(购自美国Millipore公司),涡旋振荡器(购自德国IKA公司)。
1.3 方法
1.3.1样品处理
准确称量经粉碎(90%通过40目筛)混匀后的样品5.00g,加入20mL乙腈:水:乙酸(70:29:1,体积比)混合溶剂萃取,涡旋混匀,振荡30min。随后通过4000 r/min离心10min使固液分离。准确转移0.5mL上清液到1.5mL塑料离心管中,加入0.5mL超纯水稀释,涡旋混匀,然后12000r/min离心10min,取上清液用0.22 μm的PTFE滤膜过滤,取样品滤液180 mL,加入20 mL稳定同位素混标溶液,混匀后转移到400 mL内插管中。
1.3.2仪器条件
液相色谱条件:流动相A为甲醇,B为水(含0.1%甲酸和1mM乙酸铵),洗脱梯度如下:0~2min, 90% B; 2~3min, 90% B~80% B; 3~4min, 80% B~79% B; 4~5min, 79% B~74% B; 5~7min, 74% B; 7~10.5min, 74% B~40% B; 10.5~13.5min, 40% B; 13.5~14.5min, 40% B~5% B; 14.5~17min, 5% B; 17~18min, 5% B~90% B; 18~21min, 90% B;进样量:2μL;流速:0.3mL/min
本实验采用Waters CORTECSTM UPLC C18色谱柱(100 mm × 2.1 mm,1.6 μm),柱温:40°C。
质谱条件:加热电喷雾离子源温度为300°C;毛细管电压为3.2 kV;离子传输管温度为320°C;鞘气为35 unit,辅助气为10 unit
本实验采用高分辨质谱全扫描定量:采集范围为200~800 Da,正离子采集;一级质谱分辨率为70000 m/z
2 结果
本文首先采用进口色谱纯甲醇建立了四种黄曲霉毒素的分析方法,通过反相色谱分离和高分辨质谱全扫描的模式对四种黄曲霉毒素进行定量分析。针对待测的四种黄曲霉毒素,我们均选择了M+H的带电模式作为定量离子,其相关信息见表1。在本实验中四种黄曲霉毒素的质核比的实验结果和理论值偏差均在3.5 ppb以内,具有良好的质量精度。由于采用UPLC分离,四种黄曲霉毒素的峰底宽均不超过0.15 min,因此四种毒素可以被基线分离。
表1 相关黄曲霉毒素的保留时间和选择离子的精确分子量
|
化合物 |
保留时间 |
待测离子 |
m/z 实验值 |
m/z 理论值 |
误差(ppb) |
|
AFG2 |
9.97 |
M+H |
331.0818 |
331.0809 |
2.72 |
|
AFG1 |
10.35 |
M+H |
329.0654 |
329.0653 |
0.30 |
|
AFB2 |
10.69 |
M+H |
315.0870 |
315.0860 |
3.17 |
|
AFB1 |
10.99 |
M+H |
313.0709 |
313.0703 |
1.92 |
随后,我们采用了国产分析纯甲醇替换进口色谱纯甲醇重复了相关实验。从图1中可以看出,采用国产分析纯甲醇测试四种黄曲霉毒素的提取离子色谱图可以与采用进口色谱纯甲醇的提取离子色谱图重合,可以取得完全相同的峰形,因此可以确认,在该试验中采用国产分析纯甲醇和进口色谱纯甲醇没有明显的区别。
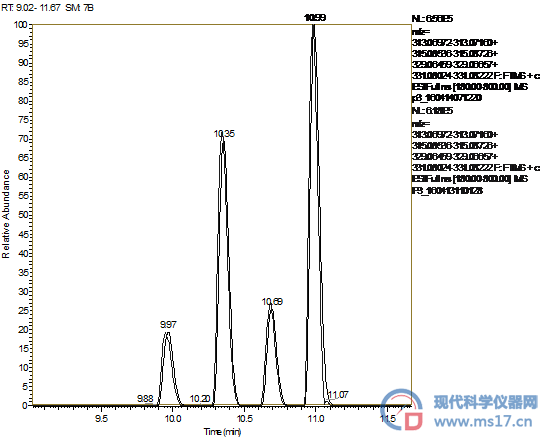
图1 四种黄曲霉毒素的液质联用提取离子色谱图,(1)号曲线是采用进口色谱纯甲醇的结果,(2)号曲线是采用国产分析纯甲醇的结果。
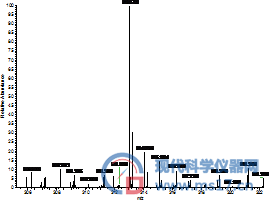
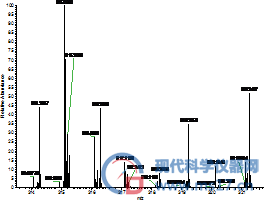
由于我们采用的是高分辨质谱采集四种黄曲霉毒素的精确质量来进行定量,接下来我们进一步考察了两种甲醇对四种黄曲霉毒素出峰时的全扫描质谱图的影响。从图2可以看出,使用两种甲醇时,四种黄曲霉毒素出峰时的全扫描质谱图也是完全相同的,完全可以满足日常检验工作的需要。
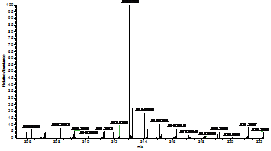
AFB1:色谱纯(左),分析纯(右)

AFB2:色谱纯(左),分析纯(右)
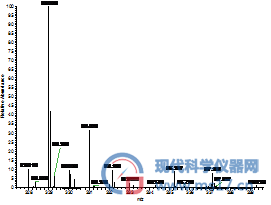
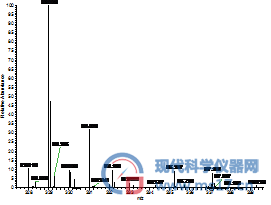
AFG1:色谱纯(左),分析纯(右)
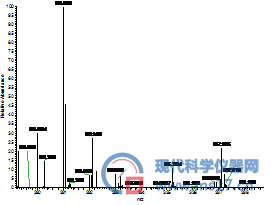
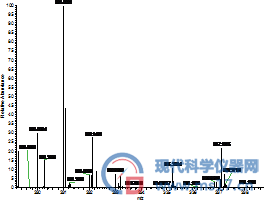
AFG2:色谱纯(左),分析纯(右)
图2 采用不同甲醇分析四种黄曲霉毒素的高分辨全扫描质谱图,其中左侧为采用国产分析纯甲醇结果,右侧是采用进口色谱纯甲醇的结果。
为了保证检验结果的准确可靠,我们进一步验证了两种甲醇作为流动相时方法的重复性和精密度。为此,我们使用两种甲醇分别进行了三次检测,其结果见表2和表3。首先,使用两种甲醇时,四种黄曲霉毒素的峰面积平均值无显著差异,这说明了两种甲醇在LC-MC分析黄曲霉毒素时是可以替换的,同时,比较四种黄曲霉毒素在采用两种甲醇实验时峰面积的RSD可以发现,两种甲醇同样没有显著差异,RSD最大的均是毒素AFB1,使用进口色谱纯甲醇的RSD为6%,而使用国产分析纯甲醇的RSD仅为4%。使用进口色谱纯甲醇四种毒素的RSD分别为6%,2%,1%和4%,而使用国产分析纯甲醇仅为4%,1%,1%和1%。因此在精密度上,使用国产分析纯甲醇甚至优于使用进口色谱纯试剂。
表2 使用进口色谱纯甲醇分析四种黄曲霉毒素定量分析结果比较
|
黄曲霉毒素种类 |
进口色谱纯 |
平均值 |
RSD(%) |
||
|
1 |
2 |
3 |
|||
|
AFB1 |
2954261 |
2629374 |
2840327 |
2814654.0 |
6 |
|
AFB2 |
766385 |
746708 |
772617 |
761894.3 |
2 |
|
AFG1 |
2146516 |
2096015 |
2133072 |
2125201.0 |
1 |
|
AFG2 |
597266 |
558202 |
587611 |
581026.3 |
4 |
表3 使用国产分析纯甲醇分析四种黄曲霉毒素定量分析结果比较
|
黄曲霉毒素种类 |
分析纯 |
平均值 |
RSD(%) |
||
|
1 |
2 |
3 |
|||
|
AFB1 |
2936038 |
3086381 |
3162254 |
3061557.7 |
4 |
|
AFB2 |
778678 |
794142 |
795648 |
789489.3 |
1 |
|
AFG1 |
2178845 |
2185052 |
2228662 |
2197519.7 |
1 |
|
AFG2 |
585098 |
596806 |
592465 |
591456.3 |
1 |
3 结论
通过比较国产分析纯甲醇和进口色谱纯甲醇在四种黄曲霉毒素的液质联用检测中结果,得出了如下结论:在用LC-MS检测这四种黄曲霉毒素的实验中,完全可以采用国产分析纯甲醇代替进口色谱纯甲醇。由于黄曲霉毒素是食品和中药材(2015版药典新增加的)检测中的常规项目,检验量在快速增加。因此本文的结论可以帮助检验人员在日常的工作中选用更加经济实惠的试剂,节省大量检验经费,为国家和单位创造更多的经济效益。
参考文献
[1] MAKI CR, THOMAS AD, ELMORE SE, et al. Effects of calcium montmorillonite clay and aflatoxin exposure on dry matter intake, milk production, and milk composition[J]. J Dairy Sci. 2016 , 99(2):1039-46.
[2] LEWIS L, onSONGO M, NJAPAU H, et al. Aflatoxin contamination of commercial maize products during an outbreak of acute aflatoxicosis in eastern and central Kenya[J]. Environ Health Perspect. 2005 ,113(12):1763-7.
[3]RHEMREV R, PAZDANSKA M, MARLEY E, et al. Automated aflatoxin analysis using inline reusable immunoaffinitycolumn cleanup and LC-fluorescence detection[J].J AOAC Int. 2015 , 98(6):1585-90.
[4]KOTINAGU K, MOHANAMBA T, KUMARI LR. Assessment of aflatoxin B1 in livestock feed and feed ingredients by high-performance thin layer chromatography[J].Vet World. 2015,8(12):1396-9.
[5] IQBAL J, ASGHAR MA, AHMED A, et al. Aflatoxins contamination in Pakistani brown rice: a comparison of TLC, HPLC, LC-MS/MS and ELISA techniques[J].Toxicol Mech Methods. 2014, 24(8):544-51.
[6]ZHANG D, LI P, YANG Y,et al. A high selective immunochromatographic assay for rapid detection of aflatoxin B[J]. Talanta. 2011,85(1):736-42.
[7] ZHANG J, LI P, ZHANG W,et al. Production and characterization of monoclonal antibodies against aflatoxin[J].Hybridoma (Larchmt). 2009,28(1):67-70.
[8] LUPO A, ROEBUCK C, DUTCHER M,et al. Validation study of a rapid ELISA for detection of aflatoxin in corn. Performance Tested Method 050901[J].J AOAC Int. 2010,93(2):587-99.
[9]CHU XF, DOU XW, KONG WJ,et al. Contamination level of aflatoxin B1 in lotus seeds rapid screening by indirect competitive ELISA method[J].Zhongguo Zhong Yao Za Zhi. 2015, 40(4):704-9.
[10] KOLOSOVA AY, SHIM WB, YANG ZY,et al. Direct competitive ELISA based on a monoclonal antibody for detection of aflatoxin B1. Stabilization of ELISA kit components and application to grain samples[J].Anal Bioanal Chem. 2006, 384(1):286-94.
[11] GAZIOĞLU I, KOLAK U. Method Validation for the Quantitative Analysis of Aflatoxins (B1, B2, G1, and G2) and Ochratoxin A in Processed Cereal-based Foods by HPLC with Fluorescence Detection[J].J AOAC Int. 2015, 98(4):939-45.
[12] HUANG S, HU D, WANG Y,et al. Automated hollow-fiber liquid-phase microextraction coupled with liquid chromatography/tandem mass spectrometry for the analysis of aflatoxin M1 in milk[J]. J Chromatogr A. 2015,1416:137-40.
[13] JESWAL P, KUMAR D. Mycobiota and Natural Incidence of Aflatoxins, Ochratoxin A, and Citrinin in Indian Spices Confirmed by LC-MS/MS[J]. Int J Microbiol. 2015,10(3):242-6.

关注本网官方微信 随时订阅权威资讯

