柱前衍生-液相色谱法测定土壤中草甘膦和氨甲基膦酸
柱前衍生-液相色谱法测定土壤中草甘膦和氨甲基膦酸
高俊海,宋桂雪*, 宋薇
(谱尼测试集团股份有限公司,北京,100080)
摘 要 本研究建立了柱前衍生-高效液相色谱-荧光检测法同时测定土壤中草甘膦和氨甲基膦酸(AMPA)残留量的检测方法,并进行了方法参数优化。实验结果表明,按照此方法测定草甘膦和AMPA时峰型尖锐、对称,保留和分离效果好,在2.0μg/L-100μg/L范围内线性关系良好(R2>0.999)。针对土壤样品加标,草甘膦回收率为82.2%-86.8%,RSD%为0.3%-2.5%,AMPA回收率为61.8%-69.1%,RSD%为0.8%-1.2%,说明本方法快捷可靠,精密度高,准确好,满足检测要求。
关键词 土壤样品;草甘膦;氨甲基膦酸;柱前衍生;高效液相色谱-荧光检测;
中图分类号 O657.63
Determination of Glyphosate and Aminomethyl Phosphonic Acid in Soil Samples by High Performance Liquid Chromatography with Pre-Column Derivatization
Gao Junhai, Song Guixue, Song Wei,
( Pony Testing International Group, Beijing, 100080 )
Abstract A method of pre-column derivatization-HPLC-FLD was established for the determination of glyphosate and AMPA in soils by optimizing the experimental conditions. The results showed that both target compounds were well separated in the chromatograms, the peaks are sharp and symmetrical. The standard curves of glyphosate and AMPA are all linearly correlated, respectively,R2>0.999, with a concentration range of 2.0-100 μg/L. The spiked recoveries of glyphosate in soil samples are in the range of 81.9%-89.3% with the relative standard deviations(RSD) from 0.3 %-2.5%, and the spiked recoveries of AMPA are in the range of 61.2% - 69.4 % with RSD from 0.8% - 1.2%. The method is quick, reliable and has good precision and accuracy.
Key Words Soil samples; glyphosate; aminomethyl phosphonic acid;pre-column derivatization; HPLC-FLD;
草甘膦(glyphosate)是一种内吸传导型非选择性广谱除草剂,高效、低成本,是目前世界上应用范围最广、产量最高的农药之一[1]。氨甲基膦酸[(Aminomethyl)phosphonic acid,AMPA]是草甘膦的主要降解产物和合成中间体。草甘膦易溶于水(1.2g/100mL,25℃),其长期广泛的施用已在部分地区生态环境中形成一定程度的迁移[2,3]。草甘膦的降解速率受其含量、温度、酸碱性和微生物作用等因素的影响较大,半衰期最长可达数年。由于草甘膦的使用有周期性,降解效率低于迁移效率时将会在环境体系中形成持久性累积残留现象。同时,AMPA与草甘膦易于共存于环境体系中,可做为指示草甘膦施用和降解效率的参考指标之一。
草甘膦常因转基因农作物备受关注[4],针对其对生物和生态环境潜在危害性应持保守态度[5]。我国GB 5749-2006 《生活饮用水卫生标准》[6]规定草甘膦残留限量为0.7mg/L,与美国环保署对地表水中的限量相同。目前尚无土壤中草甘膦残留量的规定。由于土壤中的草甘膦和AMPA可通过代谢进入植物体或通过扰动等方式二次释放污染环境,进而会通过食物链或环境对人类健康安全造成潜在危害。因此,监测和评价土壤中草甘膦和AMPA残留具有重要意义。
草甘膦和AMPA极性强,不溶于二氯甲烷、正己烷等有机溶剂,难挥发且高温易分解。由于缺少发色和荧光官能团,难以直接使用常规的色谱分离和检测手段对其进行分析,尤其是环境中的残留量很低,困难较大。目前,草甘膦和AMPA的测定方法主要有离子色谱法(IC)[7-9]、毛细管电泳法[10]、分光光度法[11]、柱前或柱后衍生-液相色谱法[12-14]、柱前衍生-气相色谱[15,16]、气相色谱-质谱法[17]、超高效液相色谱-串联质谱法[18-22]等。直接检测的方法灵敏度低,C18色谱柱分离困难,离子色谱法、毛细管电泳法和分光光度法因灵敏度或仪器较昂贵难以普及。常用的方法是将草甘膦进行衍生后检测。采用9-芴甲基氯甲酸酯(FMOC-Cl)衍生时有报道,多用超高效液相色谱-串联质谱(UPLC-MS/MS)[22,23]进行测定,但衍生条件和净化方式不一。虽然UPLC-MS/MS和OPA柱后在线衍生法检测草甘膦检测应用较多,但仪器及辅助设备普及率较低。
目前,同时检测土壤中草甘膦和AMPA残留量的液相色谱方法鲜有报道。本文通过对提取试剂、色谱条件、衍生条件和净化方法进行优化,建立土壤中草甘膦和AMPA的柱前衍生-液相色谱法。
1 材料与方法
1.1 仪器与试剂
高效液相色谱仪(Agilent 1100series,安捷伦公司),配荧光检测器;G560E涡旋混合器(Scientific Industres,Inc);THZ-82水浴恒温振荡器(常州国华电器有限公司);KH-500E超声波清洗器(昆山禾创超声仪器有限公司);CT15RT高速冷冻离心机(上海天美生化仪器设备工程有限公司);Milli-Q超纯水机(MILLIPORE公司)。
草甘膦(98.0%,Dr. Ehrenstorfer GmbH公司);氨甲基膦酸(AMPA,99.0%,AccuStandard公司);9-芴甲基氯甲酸酯(又称氯甲酸芴甲酯,FMOC-Cl,98.0%,Acros公司);固相萃取柱C18(Agela, 3mL/50mg)和HLB(Waters Oasis,3mL/50mg);实验用水均为超纯水系统制备;二氯甲烷(色谱纯,TEDIA);乙腈(色谱纯,Fisher);甲醇(色谱纯,Fisher);乙酸铵、四硼酸钠、磷酸、氢氧化钠、盐酸等试剂均为分析纯;0.45μm MCM醋酸纤维素膜;一次性注射器;广泛pH试纸(1-14)。
1.2 样品制备
将采集的土壤样品,风干后过60目筛,混匀,密封保存。
1.3 标准溶液配置
称取适量草甘膦和AMPA标准物质于10mL聚四氟乙烯容量瓶中,以水溶解并定容至刻度,配置成1000 mg /L的标准储备液,于4℃保存。根据实验需要,可将标准储备液用水稀释配置一定浓度的混合标准工作液。
1.4 样品预处理
1.4.1 提取
称取约5g制备的试样于具塞50mL塑料离心管中,准确加入20mL 0.1mol/L NaOH溶液,涡旋混匀,超声振荡提取2h,8000 rpm离心5 min,分取8.0mL上清液于10mL塑料离心管中,用1.0 mol/L 盐酸溶液或1.0 mol/L NaOH溶液调整其pH至中性,水定容至10.0mL刻度,过0.45μm滤膜,弃去前2 mL,滤液收集于10mL塑料离心管中,待净化。
1.4.2 净化
HLB固相萃取柱经3mL甲醇和3mL超纯水活化,2mL待净化溶液平衡,待液面到达柱吸附层表面时,再次加入2mL待净化溶液,收集流出液,待衍生化处理。
1.4.3 衍生
准确量取1.0 mL滤液于10 mL塑料离心管中,加入0.5mL 0.05mol/L 四硼酸钠水溶液,涡旋混匀,再加入0.5mL 0.1% (质量分数)FMOC-Cl乙腈溶液,涡旋混匀,室温静置10min。待衍生完全,加入0.5mL 2%(体积分数)磷酸,涡旋混匀,再加入约2.5mL二氯甲烷,涡旋混匀,静置待分层,吸取上层水相,密封,待测。
1.5 标准曲线绘制
准确量取一定体积混合标准工作液,水稀释并配置成2.0、5.0、10.0、20.0、50.0、100.0μg/L的系列混合标准溶液。分别量取系列混合标准溶液1.0mL于10mL塑料离心管中,其他步骤同1.4.3衍生,配制成的标准工作曲线,密封,待测。按照测定条件对标准溶液进行测试,以目标物的峰面积(A)为纵坐标,以相应的浓度为横坐标绘制标准曲线,外标法定量。
1.6 高效液相色谱-荧光检测条件
色谱柱SHIMADZU-GL InertSustain C18,250mm×4.6mm,5μm;激发波长254nm;发射波长315nm;柱温:35℃;进样量20μL;流速1.0 mL/min;流动相 5mmol/L 乙酸铵(A)和乙腈(B),梯度洗脱,洗脱程序见表1。
表1 梯度洗脱程序
Table1. Gradient elution procedures
|
时间/min |
5mmol/L乙酸铵 |
乙腈 |
|
0 |
90 |
10 |
|
2 |
90 |
10 |
|
6 |
80 |
20 |
|
16 |
80 |
20 |
|
30 |
50 |
50 |
|
31 |
10 |
90 |
|
36 |
10 |
90 |
|
37 |
90 |
10 |
|
40 |
90 |
10 |
2 结果与分析
2.1 色谱图和标准曲线
按上述仪器条件进行测定,记录5.0μg/L草甘膦和AMPA标准溶液色谱图(图1),并按照“1.5 标准曲线绘制”绘制标准曲线,见图2。
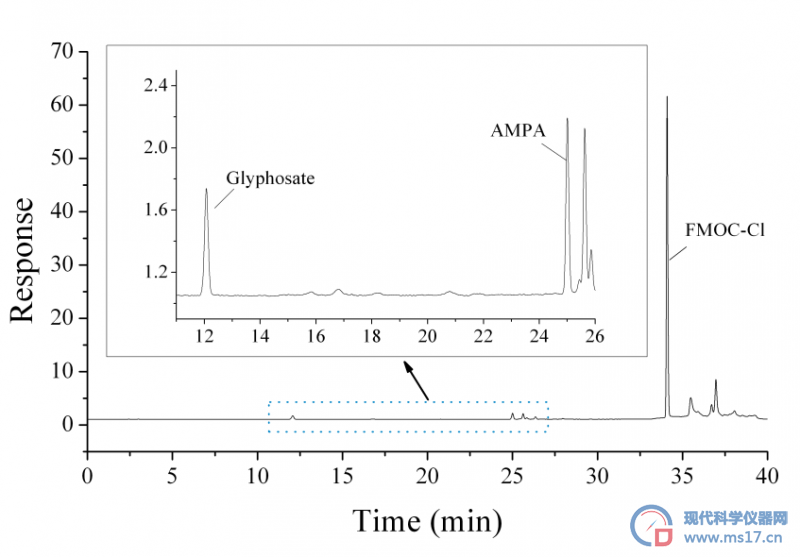
图1. 草甘膦和AMPA标准溶液色谱图(5.0μg/L)
Fig1. Standard chromatograms of glyphosate and AMPA (5.0μg/L)
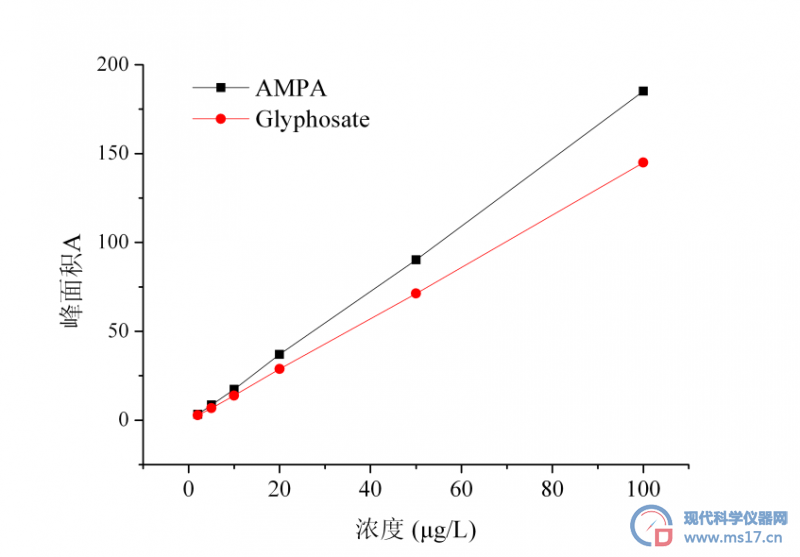
图2. 草甘膦和AMPA标准曲线
Fig2. Standard curves of glyphosate and AMPA
如图1~2所示,草甘膦和AMPA在2.0 μg/L-100μg/L范围内线性关系良好,草甘膦的线性方程为y=1.4492x-0.3766(R2=0.9999),AMPA的线性方程为y=1.8528x-0.8178(R2=0.9998),能够满足外标法定量检测的要求。同时,荧光检测器对草甘膦-FMOC-Cl衍生产物具有较高的灵敏度,可以满足实际样品检测的需求。
2.2 衍生条件的选择
采用七氟丁醇(HFB)和三氟乙酸酐(TFAA)高温衍生或邻苯二醛(OPA)和2-巯基乙醇(MERC)碱性条件避光衍生等方式对草甘膦进行衍生化处理,操作条件苛刻,且前处理繁琐,容易产生衍生产物淬灭等现象。综合考量衍生操作的便捷性、衍生产物的稳定性等因素,本方法选择了9-芴甲基氯甲酸酯(FMOC-Cl)作为衍生试剂。原理为草甘膦和AMPA分子结构中N-H的H-原子被FMOC-基团取代引入强荧光基团并降低极性,有利于高效液相色谱反相柱(C18)的分离保留和荧光检测。本研究在保证衍生试剂过量的前提下,对衍生时间、衍生pH、衍生终止、衍生后净化等条件进行了优化。
参考文献资料[24]可知pH约为9时该衍生反应效率最佳,故选择0.05mol/L 四硼酸钠水溶液的碱性环境。但待衍生液的pH对于衍生体系pH的影响也尤为关键,本研究分别设置酸性(pH<3)、中性(pH=6)和碱性(pH>11)三组待衍生液,按照“1.6”的条件衍生3h后即刻分析。实验结果表明:待衍生液碱性时衍生反应缓慢,且衍生不完全,待衍生液酸性时未检出衍生产物,当待衍生液中性时衍生完全且峰型良好。因此,在衍生时,应尽量保证待衍生液的pH接近中性。
本研究针对衍生时间设置两个梯度5组实验,分别将5.0 μg/L和50 μg/L的混合标准溶液于室温衍生10min、30min、1h、2h、3h、4h,按照“1.6”的条件即刻分析并记录峰面积,见图3。实验结果表明,草甘膦在10min便可衍生完全,AMPA则需衍生2h以上,综合考量未知因素影响和衍生效果,将本方法的衍生时间设定为静置2h。但单独测定草甘膦时,可将方法的衍生时间设定为10min。
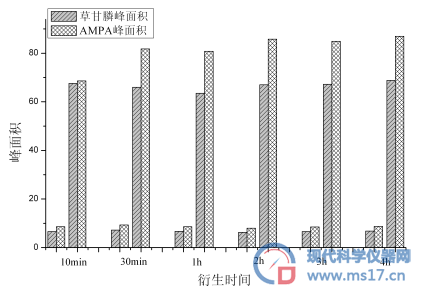
图3. 草甘膦和AMPA衍生时间对峰面积的影响(浓度分别为5.0 μg/L和50 μg/L)
Fig3 . Effects of different derivatization times of Glyphosate and AMPA on their peak areas
同时可知,当pH降至酸性时可有效终止衍生反应,且衍生产物在酸性条件下其离子化作用将被有效抑制,有利于色谱分离检测。因此选择2%磷酸溶液做为终止衍生试剂。将衍生溶液直接测试,杂峰较多且衍生试剂峰存在平顶现象,对检测器和色谱柱存在一定的影响,本方法采用二氯甲烷液液萃取净化的方式消除影响。实验结果表明,二氯甲烷萃取在去除样液中大部分的衍生试剂和杂质的同时不会造成衍生产物的损失,同时还可降低样液中乙腈的含量,故本方法确定了二氯甲烷液液萃取净化的条件。
2.3 色谱条件优化
SHIMADZU-GL InertSustain C18色谱柱相比于常规C18色谱柱具有较高的惰性,即使强离子性化合物也可获得尖锐的峰型,残留物也易清洗。因此选择该色谱柱检测草甘膦衍生产物可获得较好的峰型和保留稳定性。选择乙腈-水和乙腈-5mmol/L乙酸铵水溶液的流动相体系进行比对,因样液存在一定的酸碱性,乙腈-水的缓冲能力较弱,尤其是针对在未加入2%磷酸的样液进行检测时,由于目标物离子化程度较强,难以得到尖锐完整的峰型,而乙腈-5mmol/L乙酸铵水溶液具有较强的缓冲能力。最终选择乙腈-5mmol/L乙酸铵水溶液作为该方法的流动相。且土壤基质即便在净化后仍较为复杂且衍生产物的非极性较弱,选择高比例水相有利于较好的保留和分离效果,草甘膦在20%有机相便可充分洗脱,而AMPA则需要在35-45%有机相才可充分洗脱,需要设置梯度洗脱程序。同时为保证单针杂质的充分清洗,在目标物出峰后提高有机相比例快速洗脱,并最终平衡回初始比例,该方法中的流动相体系和比例保证了较高的分离度和重复性。
2.4 提取条件的选择
土壤中富含有机质和活性矿物质成分,对草甘膦和AMPA具有吸附和络合作用,提取土壤中残留的草甘膦和AMPA存在一定难度。先前研究人员曾[22,25-28]分别采用水、酸、碱等不同溶液进行提取,获得的结果表明,水和0.5%磷酸溶液的提取效率低于30%,且随提取液碱性增强,0.6mol/L KOH溶液的提取效率可高达96%。说明碱性提取液可破坏土壤中有机质对草甘膦和AMPA的吸附结构,并与活性矿物成分沉淀释放络合物中的草甘膦和AMPA离子。设计提取实验对此研究结果进行验证,选择0.1mol/LHCl溶液、蒸馏水和0.1mol/L NaOH分别提取,结果表明0.1mol/L HCl和蒸馏水的提取效率明显低于0.1mol/L NaOH溶液,这与文献资料的结论相一致。因此,本研究选择0.1mol/L NaOH提取液进行提取。为保证提取效率和稳定性,本研究最终采用水浴振荡、超声2h的提取方法。
2.5 净化方法优化
草甘膦属于强离子性化合物,且具多种可电离官能团,其样品溶液离子特性、萃取柱吸附活性和洗脱强度难以准确控制[22],因此为选择离子交换净化柱作为净化手段。本研究分别选择HLB和C18固相萃取柱进行净化,两种固相萃取柱对离子性物质不容易保留,但可对样液中的有机杂质进行吸附,省去传统洗脱、浓缩等步骤,而HLB对极性化合物杂质的吸附效果强于C18。鉴于水溶液提取的极性杂质较多且方法中二氯甲烷净化可除去部分中等极性杂质,因此选择HLB作为净化手段。采用pH值为3、7、13的提取液过柱,在pH=3和pH=13时均存在较大的损失,而pH=7时效果最佳。因此,本研究确定了中性上样、HLB净化的方法。
2.6 方法学验证
取阴性土壤样品,进行加标试验,按照前述方法处理平行测定3次,回收率和精密度见表2。
表2. 土壤样品加标回收率、 精密度、方法检出限和方法定量限(n=3)
Table2. Spiked recoveries ,precision ,LOD and LOQ of glyphosate and AMPA
in two spiked levels of soil samples(n=3)
|
|
加标水平(mg/kg) |
回收率(%) |
RSD(%) |
LOD(mg/kg) |
LOQ(mg/kg) |
|
草甘膦 |
0.02 |
86.8 |
2.5 |
0.002 |
0.006 |
|
0.08 |
82.2 |
0.3 |
|||
|
AMPA |
0.05 |
61.8 |
1.2 |
0.003 |
0.009 |
|
0.20 |
69.1 |
0.8 |
如表2所示,在加标浓度0.02mg/kg和0.80mg/kg,草甘膦加标回收率范围为82.2%-86.8%,RSD为0.3%-2.5%;在加标浓度0.05mg/kg和0.20mg/kg AMPA加标回收率范围为61.8%-69.1%,RSD为0.8%-1.2%,表明所建方法重复性良好,虽然AMPA的回收率偏低,但在加标水平小于0.1mg/kg时,回收率在60%-120%也可以接受。按照检出限为S/N=3、定量限S/N=10来计算,本方法测定土壤中草甘膦的检出限和定量限分别为0.002mg/kg和0.006mg/kg,AMPA的检出限和定量限分别为0.003mg/kg和0.009mg/kg,说明本方法具有较高的灵敏度。虽然略高于UPLC-MS/MS测定草甘膦和AMPA检出限的0.0008mg/kg和0.0009mg/kg[22],但液相色谱-荧光法仍可满足目前草甘膦和AMPA残留量的检测需求。
2.7 样品测定
于本测试中心环境样品库选择惠州、黑龙江、湖南和北京等地的不同类型土壤,按照本研究方法进行实际测定测定。如表3所示,草甘膦在选择的土壤样品中均未检出,但AMPA的检出率在5种不同土壤中4种有检出,且含量在0.011-0.023mg/kg之间。在刘拉平[22]的研究结果中,草甘膦残留偶有检出,但含量大多在0.002mg/kg以下(含量低于本研究方法草甘膦检出限),且AMPA的检出含量大多在0.001-0.022mg/kg之间。表明本研究和先前科研人员的研究结果相一致。土壤中有AMPA检出的情况,说明在目前草甘膦广泛大量使用的情况下,草甘膦在大部分地区可能已经出现残留和降解现象。
表3. 实际样品测定
Table 3. The determination results of various soil samples
|
编号 |
样品来源地 |
土壤类型 |
草甘膦含量mg/kg |
AMPA含量mg/kg |
|
1 |
惠州 |
水稻土 |
N.D |
0.011 |
|
2 |
黑龙江 |
黑钙土 |
N.D |
0.023 |
|
3 |
湖南 |
红壤 |
N.D |
0.019 |
|
4 |
惠州 |
赤红壤 |
N.D |
0.011 |
|
5 |
北京 |
褐土 |
N.D |
N.D |
N.D表示未检出(Not Detected)
3 结论
本研究通过控制变量实验,确定了土壤中草甘膦和AMPA残留量的测定方法,采用0.1mol/L NaOH溶液提取、中性样液HLB固相萃取净化、FMOC-Cl碱性条件常温2h衍生化处理、二氯甲烷净化的方法制备待测溶液,高效液相色谱-荧光检测法检测,外标法定量。本方法适合土壤的检测,操作便捷,且具有较高的灵敏度、准确性和精密度,可以满足土壤中微量残留的检测要求,对环境中草甘膦残留的监管和评估提供较好的技术支持。
参考文献
[1] 梁诚. 草甘膦生产现状与市场分析[J]. 精细化工原料及中间体,2011,( 8) : 13-15.
[2]卢信,赵炳梓,张佳宝,等.除草剂草甘膦的性质及环境行为综述[J]. 土壤通报,2005,36( 5) : 785-790.
[3] 张伟,王进军,高立明,等.草甘膦在水-土壤系统中的环境行为及研究进展[J]. 农药,2006,45( 10) : 649-654.
[4]王慧,闫晓红,徐杰,等.我国抗草甘膦基因的发掘现状[J]. 农业生物技术学报,2014,22( 1) : 109-118.
[5]周垂帆,李莹,张晓勇,等.草甘膦毒性研究进展[J].生态环境学报,2013,22( 10) : 1737-1743.
[6]中华人民共和国卫生部,中国国家标准化管理委员会. GB 5749-2006 生活饮用水卫生标准[S]. 北京: 中国标准出版社,2006.
[7]Guo ZX, Cai QT, Yang ZG. Ion Chromatography /Inductively coupled plasma mass spectrometry for simultaneous determination of glyphosate,glufosinate, fosamine and ethephon at nanogram levels in water [J]. Rapid Commun.Mass Spectrom,2007,21(10):1606-1612.
[8]李祥平,齐剑英,陈永亨,等.离子色谱法测定地表水中的卤乙酸和草甘膦[J].应用化学,2009,26( 4) : 447-450.
[9]张培志,吴军,张培敏,等.土壤中草甘膦的离子色谱法测定[J] . 分析测试学报,2003,22( 4) : 89-90.
[10] Corbera M,Hidalgo M,Salvadó V,et al. Determination of glyphosate and aminomethylphosphonic acid in natural water using the capillary electrophoresis combined with enrichment step [J].Analytica Chimica Acta,2005,540( 1) : 3 -7.
[11]董文庚,陈学诚,朗志敏,等. 褪色分光光度法间接测定草甘膦. 分析化学,1997,25(10) : 1210-1212.
[12]Montrap, Jayanta S, Mitras,et al.Micro-scale membrane extraction of glyphosate and aminomethyl phosphonic acid in water followed by high-performance liquid Chromatography and post-column derivatization with fluorescence detector[J]. Journal of Chromatography A,2008,1189(1-2): 483 -492.
[13]Qian K,Tang T,Shi TY ,et al.Residue determination of glyphosate in environmental water samples with high-performance liquid Chromatography and UV detection after derivatization with 4-chloro- 3,5-dinitrobenzotrifluoride[J]. Analytica Chimica Acta,2009,635(2) : 222-226.
[14]张蓓蓓,张立志,章勇. 水中草甘膦和氨甲基膦酸的柱前衍生-液相色谱方法研究[J]. 环境监控与预警,2015,7(2):13-19.
[15] 胡继业,赵殿英,宁君,等. 气相色谱-氮磷检测器测定草甘膦在土壤和苹果中的残留量[J].农药学学报,2007,9 (3) :285-290.
[16]马为民,牛森,李东运,等.气相色谱法测定几种蔬菜水果中草甘膦残留[J].农药,2006,45(4) : 261-262.
[17]程雪梅,周敏. 气相色谱-质谱法测定香蕉和灌溉水中的草甘膦及其代谢物的残留量[J]. 色谱,2004,22(3) : 288.
[18]Hao CY,Morse D,Motta F,et al. Direct aqueous determination of glyphosate and related compounds by liquid Chromatography /tandem mass spectrometry using reversed-phase and weak anion-exchange mixed-mode column[J]. Journal of Chromatography A,2011,1218(33) : 5638- 5643.
[19]Sanchis J,Kantiani L,Llorca M,et al. Determination of glyphosate in groundwater samples using an ultrasensitive immunoassay and confirmation by on-line solid-phase extraction followed by liquid Chromatography coupled to tandem mass spectrometry[J]. Anal Bioanal Chem,2012,402(7) : 2335 -2345.
[20]Hanke I,Singer H,Hollender J,et al.Ultratrace-level determination of glyphosate, aminomethylphosphonic acid and glufosinate in natural waters by solid-phase extraction followed by liquid Chromatography-tandem mass spectrometry: performance tuning of derivatization, enrichment and detection[J]. Anal Bioanal Chem,2008,391(6) : 2265 -2276.
[21]郑和辉,张静,李洁,等. 超高效液相色谱串联质谱法直接进样测定水中的草甘膦和呋喃丹[J]. 分析试验室,2008,27(12) : 68-70.
[22]刘拉平,武瑜,王玉堂,等. 柱前衍生高效液相色谱-串联质谱法测定土壤中草甘膦及其主要代谢物氨甲基膦酸[J]. 农药学学报,2015,17(4):439-446.
[23]成婧,王美玲,龚强,等. 液相色谱-串联质谱法检测植物源食品中草甘膦及其代谢物的残留量. 食品安全质量检测学报,2016,7(1):138-144.
[24]诸力,陈红平,周苏娟,等. 超高效液相色谱-串联质谱法测定不同茶叶中草甘膦、氨甲基膦酸及草铵膦的残留[J]. 分析化学研究报告,2015,43(2):271-276.
[25] Roy D N ,陆贻通. 土壤中草甘膦及其代谢产物残留测定方法的改进[J]. 农药译丛,1990,12(3):47-49.
[26]司友斌,桑忠营,程凤侠. 对甲基苯磺酰氯衍生化液相色谱法测定土壤中草甘膦 [ J]. 安徽农业大学学报,2009,36(1) : 136-139.
[27] 张培志,吴军,张培敏,等.土壤中草甘膦的离子色谱法测定[J]. 分析测试学报,2003,22( 4) : 89 -90.
[28]汪立高,杨仁斌,魏凤. 土壤中残留草甘膦检测方法及其消解动态研究 [J].湖南农业科学,2011( 23) : 85-88.
(资讯来源:《现代科学仪器》,由“现代科学仪器网”官方发布,转载请注明来源。
想获取更多新闻资讯,欢迎访问“现代科学仪器网”)

关注本网官方微信 随时订阅权威资讯

