大花红景天中红景天苷与酪醇的分离制备
大花红景天中红景天苷与酪醇的分离制备
贺天雨1,2,王尉1,2,徐双双1,2,赵新颖1,2,张经华1,2
(1 北京市理化分析测试中心,北京 100089;2 有机材料检测技术与质量评价北京市重点实验室,北京 100094)
摘 要: 目的:建立一种快速高效的制备分离红景天中红景天苷与酪醇的方法。方法:采用高速逆流色谱法对红景天乙醇提取物中的红景天苷和酪醇进行富集,溶剂体系为正丁醇:乙酸乙酯:水(2:3:5),仪器转速900 r/min,流速2 mL/min,检测波长254 nm。对富集后的样品进行半制备液相色谱二次纯化,流动相为甲醇-水,流速4 mL/min,检测波长275 nm。通过紫外-可见光谱、红外光谱、质谱、核磁共振波谱对红景天苷和酪醇进行了结构确证。结论:该方法操作简单、制备量大、纯度高,可为新药研究和工业化生产提供参考。
关键词:分离制备;红景天苷;酪醇;高效液相色谱法;高速逆流色谱法
中图分类号:R284
Separation and Preparation of Salidroside and Tyrosolfrom Rhodiolacrenulata
He Tianyu1,2, Wang Wei1,2, Xu Shuangshuang1,2,Zhao Xinying1,2,
Zhang Jinghua1,2
(1 Beijing Centre for Physical and Chemical Analysis, Beijing 100089, China
2BeijingKey Laboralory of Detection Technology & Quality evaluation of Organic Material,Beijing100094,China)
Abstract: Objective:A rapid and efficient method for preparation of Salidroside and Tyrosol from Rhodiola crenulata was established. Methods:Salidroside and tyrosol in the Rhodiola crenulata ethanol extract were enriched by using HSCCC with N-butanol: ethyl acetate: water (2: 3: 5)as the solvent system, The flow rate was 2mL/min while the apparatus rotated at 900 r/min and the detection wavelength was at 254 nm. The concentrate was purified by semi-preparative liquid chromatography furtherly. The mobile phase consisted of methanol-water, the flow rate was 4 mL/min, and the detection wavelength was 275nm. The structures of salidroside and tyrosol were confirmed by UV-Vis, IR, MS and NMR spectroscopy. Conclusion:The method that has the advantages of simple operation, large preparation volume and high purity can provide reference for new drug research and industrial production.
Key words: separation preparation; salidroside; tyrosol; high performance liquid chromatography; high-speed counter-current chromatography
我国的红景天属资源十分丰富,共有70多种,大约是世界红景天资源的 80%[1]。红景天种类植物的根茎甚至是全株既有药用价值,也可作为保健食品的原材料,且红景天种类植物具有低温干燥、昼夜温差大与缺氧等严苛的生长条件,使其拥有了极强的生命力与适应能力。随着现代社会人们的生活水平不断提高,对天然的、无毒副作用的食品、药品或保健品的需求量不断上升[2]。
本文所使用的原材料是大花红景天,主要化学成分有苷类[3-4]、黄酮类[5]、有机酸类[6]、挥发油类[7]、糖苷类[6、8]等。红景天苷及其代谢产物酪醇是红景天属植物中广泛存在的两种化合物,具有抗疲劳[9]、抗衰老[10]、抗缺氧[11]、抗辐射[12]以及抗癌[13-14]等多种药理作用,可以预防和治疗多种疾病[15]。
本文首次尝试采用高速逆流色谱与半制备液相色谱相结合的方法分离制备红景天苷与酪醇,产品纯度达到99%以上。并通过紫外-可见光谱、红外光谱、质谱、核磁共振波谱对以上两种化合物进行了结构确证。该制备方法具有上样量大,回收率高的特点,为新药的研究开发与红景天药材的应用提供了参考依据。
1材料与方法
1.1 仪器与材料
KQ-250E超声波清洗器(昆山市超声仪器有限公司);TBE-300B半制备型高速逆流色谱仪(上海同田生物技术有限公司);LC-20高效液相色谱仪(日本Shimadzu公司);1525EF半制备型液相色谱(美国Waters公司);RE-2000旋转蒸发仪(上海亚荣生化仪器厂);ALPHR1-2冷冻干燥机(德国Marin Christ公司)。
乙酸乙酯,甲醇,正丁醇(北京化工厂);乙醇(色谱纯,Thermo Fisher公司)。
2 实验部分
2.1红景天的提取
以大花红景天为原料提取红景天粗提物。用电子天平称取500 g大花红景天,粉碎过60目筛。乙醇为提取溶剂,料液比1:10,提取1h,过滤,重复提取2次,合并滤液,使用旋转蒸发仪进行浓缩后,冷冻干燥,备用。
2.2红景天HPLC分析方法
色谱柱为Aglient ZORBAX SB-C18(250 mm×4.6 mm, 5 μm);流动相:A为甲醇,B为水,0-20 min,20%A;流速:1.0 mL/min;柱温:30℃;运行时间20 min;检测波长为275 nm;进样量5μL。
2.3红景天苷与酪醇的分离制备
2.3.1高速逆流色谱法富集
HSCCC溶剂体系为正丁醇:乙酸乙酯:水=2:3:5,将配制好的溶剂静置过夜,取上相为固定相,下相为流动相,分别超声脱气30 min。
HSCCC操作过程如下:称取红景天粗提取物250 mg,等体积上下相溶解后,备用。泵入固定相(上相),流速10 mL/min,泵入固定相400 mL;换流动相(下相),主机正转,缓慢调节转速至900 r/min;泵入流动相,流速2 mL/min;25℃分离温度,波长254nm下检测。待流动相从出口流出时,上样。根据HSCCC图收集目标化合物,旋转蒸发去除溶剂,冷冻干燥后备用。
2.3.2半制备型液相色谱分离纯化
色谱条件:半制备型色谱柱xBridge Prep-C18(10 mm×150 mm, 5 μm);红景天苷样品半制备液相色谱流动相为甲醇/水=20:80,运行时间30 min,检测波长为275 nm;酪醇样品半制备液相色谱流动相为甲醇/水=25:75,运行时间30 min;检测波长为275 nm。
收集目标馏分,旋转蒸发去除溶剂,冷冻干燥后最终得到红景天苷样品及酪醇样品。
2.4 结构确证
本文采用紫外-可见光谱(UV-Vis)、红外光谱(IR)、质谱(MS)、核磁共振(NMR)进行结构确证。
2.4.1 紫外-可见光谱分析条件
使用甲醇为溶剂配制红景天苷、酪醇0.1 mg/mL,扫描范围200-600 nm。
2.4.2红外光谱分析条件
KBr压片法;扫描范围4000-400 cm-1;分辨率4 cm-1;扫描次数64次。
2.4.3高分辨质谱分析条件
HPLC分析条件:色谱柱Agilent Eclipse XDB-C18(150 mm×3.0 mm, 3.5 μm);流动相:A为甲醇,B为水,0-20 min,其中红景天苷为15%A,酪醇为30%A;流速:0.4 mL/min;柱温:30℃;运行时间:20 min。
MS条件:正、负两种离子模式,Sheath gas 40 L/min;Aux gas:15 L/min;Spray voltage:3.0 kV;Capillary temp:320℃;Aux Gas heater temp:350℃;Scan:150 to 2200 m/z。
2.4.4核磁共振分析条件
氘代试剂CD3OD,TMS内标,检测1H-NMR和13C-NMR。
3 结果与讨论
3.1红景天样品分析
采用HPLC法对红景天粗提取物和红景天苷对照品、酪醇对照品进行分析,见图1。确定保留时间7.3min的化合物为红景天苷、保留时间8.4 min的化合物为酪醇。
|
|
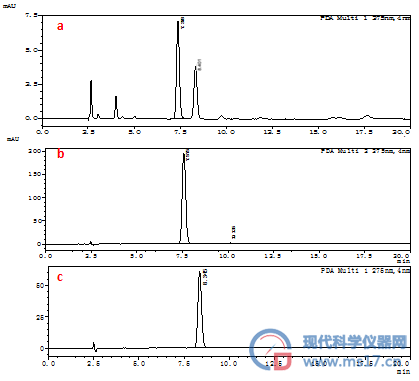
图1 红景天HPLC色谱图
a.红景天粗提物;b.红景天苷对照品;c.酪醇对照品
3.2红景天苷与酪醇的分离制备
|
|
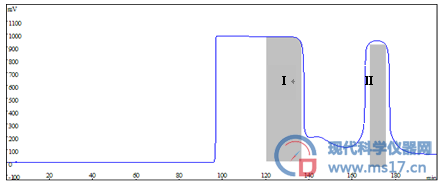
图2 红景天提取物HSCCC色谱图
对HSCCC获得的红景天苷与酪醇样品进行二次分离纯化,按2.2.2条件进样,收集23-28 min馏分Ⅲ,为红景天苷。收集42-45 min馏分Ⅳ,为酪醇。见图3。
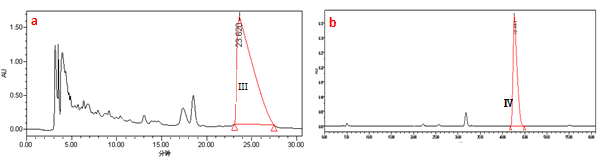
a.红景天苷样品半制备液相色谱图;b.酪醇样品半制备液相色谱图;
图3半制备液相色谱图
对纯化后的红景天苷样品与酪醇样品进行纯度分析,见图4,经扣除溶剂色谱峰后,对样品色谱峰进行面积归一法,测定红景天苷纯度为99.6%;测定酪醇纯度为99.9%。
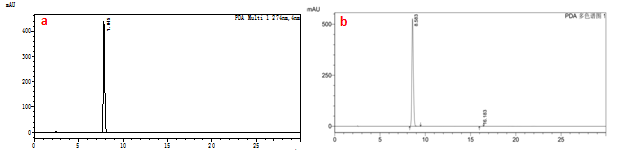
图4HPLC色谱图
a.纯化后的红景天苷;b.纯化后的酪醇
3.3 红景天苷和酪醇的结构确证
3.3.1紫外-可见光谱分析
通过对制备得到的红景天苷和酪醇进行紫外-可见光谱扫描,分别见图5,在279 nm和278 nm处有最大紫外吸收,符合红景天苷和酪醇的紫外吸收的特征。
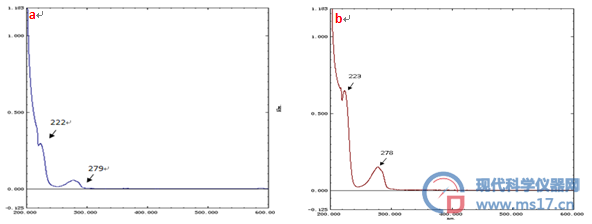
图5 紫外-可见光谱图
a.红景天苷;b.酪醇
3.3.2 红外光谱分析
通过对制备得到的样品进行红外光谱扫描,见图6。红景天苷官能团归属如下:3281 cm-1:OH的对称伸缩振动;2952 cm-1:CH2的对称伸缩振动;1615 cm-1:苯环的伸缩振动;1517 cm-1:苯环的伸缩振动;1444 cm-1:CH2的变形振动;1242 cm-1:CH2的卷曲振动;1073 cm-1:C-O-C不对称伸缩振动吸收;1012 cm-1:C-O-C对称伸缩振动吸收;823 cm-1:苯环邻二位质子。
酪醇官能团归属如下:3386 cm-1:OH的伸缩振动;3134, 3023 cm-1:芳烃的伸缩振动;2927 cm-1:CH2的伸缩振动;2879 cm-1:CH2的伸缩振动;1598,1512 cm-1:芳烃的C=C伸缩振动;1451 cm-1:CH2的卷曲振动;1345 cm-1:βOH;1232 cm-1:C-C伸缩振动吸收;1053 cm-1:C-O伸缩振动吸收;817 cm-1:苯环上2个邻位H。
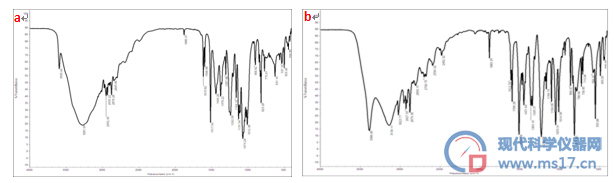
图6 红外光谱图
a.红景天苷;b.酪醇
3.3.3高分辨质谱分析
通过对制备得到的红景天苷进行高分辨质谱正、负离子模式扫描,见图7。可得[M+Na]+=323.1099与计算的精确分子量323.1107基本一致,[M-H]-=299.1129与计算的精确分子量299.1131基本一致,[2M-H]-=599.2330与计算的精确分子量599.2340基本一致。以上数据与红景天苷分子量和化学式一致。
通过对制备得到的酪醇进行高分辨质谱正、负离子模式扫描,见图8,可得[M-H]-=137.0593与计算的精确分子量137.1643基本一致。酪醇正离子模式下未产生离子碎片。
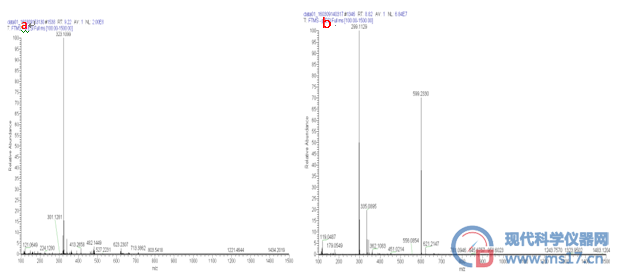
图7红景天苷质谱图
a.正离子模式下;b.负离子模式下
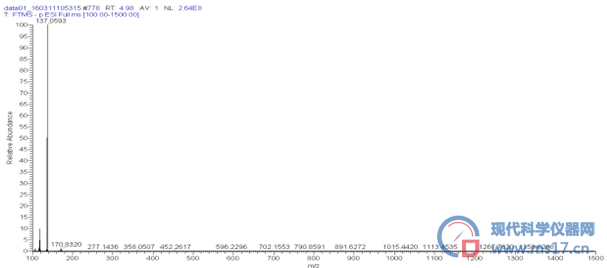
图8酪醇负离子模式下质谱图
3.3.4 1H-NMR和13C-NMR
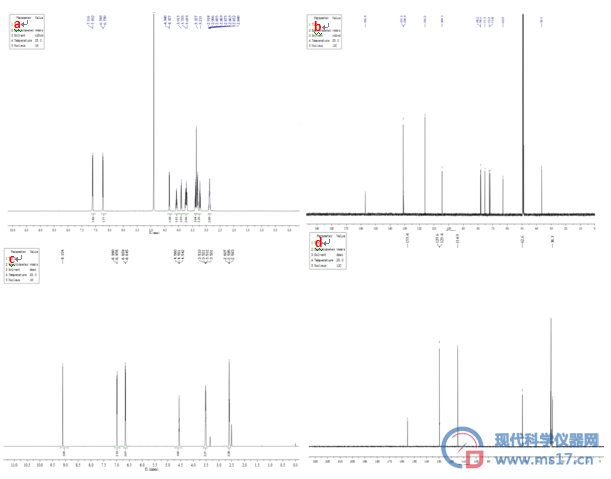
图9 核磁共振图谱
a.红景天苷1H-NMR;b.红景天苷13C-NMR;c.酪醇1H-NMR ;d.酪醇13C-NMR
表1 红景天苷和酪醇1H-NMR和13C-NMR数据(氘代溶剂CD3OD)
|
编号 |
红景天苷 |
酪醇 |
||
|
δH |
δC |
δH |
δC |
|
|
1 |
- |
156.9 |
- |
155. 4 |
|
2 |
6.74(2H,d,J=7.8 Hz) |
116.2 |
6.65(2H,dd,J=8.4Hz) |
114. 9 |
|
3 |
7.11(2H,d,J=8.4 Hz) |
130.9 |
6.98(2H,dd,J=8.4Hz) |
129.6 |
|
4 |
- |
131.1 |
- |
129. 4 |
|
5 |
7.11(2H,d,J=8.4 Hz) |
130.9 |
6.98(2H,dd,J=2.4Hz) |
129.6 |
|
6 |
6.74(2H,d,J=7.8 Hz) |
116.2 |
6.65(2H,dd,J=2.4Hz) |
114. 9 |
|
7 |
2.85(2H,m) |
36.5 |
2.60(2H,t,J=7.2 Hz) |
38.3 |
|
8 |
3.22(2H,m) |
72.2 |
3.51(2H,m) |
62. 6 |
|
1’ |
4.33(1H,d,J=7.8 Hz) |
104.5 |
- |
- |
|
2’ |
3.29-3.39(7H,m) |
75.3 |
- |
- |
|
3’ |
3.29-3.39(7H,m) |
78.2 |
- |
- |
|
4’ |
3.29-3.39(7H,m) |
71.8 |
- |
- |
|
5’ |
3.29-3.39(7H,m) |
78.1 |
- |
- |
|
6’ |
3.29-3.39(7H,m) |
62.9 |
- |
- |
对制备获得的高纯度红景天苷样品与酪醇样品进行定性分析,通过对数据的分析和归属确认了所制备的样品为红景天苷与酪醇。
4 结论
随着现代社会人们的生活水平不断提高,红景天的提取物被广泛添加到各类商品中。为了满足中草药及药品分析检测及质量监控工作的需求,本文采用超声辅助法对红景天苷和酪醇分别进行粗提取,高速逆流色谱技术进行初步纯化,半制备型液相色谱对提取物进一步分离纯化,制备出高纯度红景天苷样品和酪醇样品。该制备工艺具有分离效果好、产物纯度高、分离产量大的特点,为红景天资源的进一步开发应用提供了参考依据。
参考文献
[1] 朱盼盼.红景天苷提取及大孔树脂纯化工艺研究[D].武汉 :武汉轻工大学,2014.10-17
[2] 中国科学院中国植物志编辑委员会.中国植物志 34 卷 (第一分册)[M].北京: 科学出版社,1986.
[3] 王爱玲,曲玮,梁敬钰红景天属植物化学成分及药理作用研宂进展海峡药学,2014,01:1-8.
[4] 王建元.红景天有效成分提取工艺及微量元素研究[D].成都:西南交通大学,2013.
[5] 韩颖,金艺淑,于建婷,等.高山红景天黄酮类化合物的分离与鉴定[J].沈阳药科大学学报,2011,28(2): 116.
[6] 王曙,王锋鹏.大花红景天化学成分的研究[J].药学学报,1992,27(2):117.
[7] 田军,鲍燕燕王瑞冬红景天挥发油的化学成分研究军事医学科学院院刊,2000,24(1):49-51.
[8] 黄英俊,赵明,宗玉英,等.狭叶红景天的化学成分及其抑制结核分枝杆菌生长活性的研究[J].中国中药杂志,2008,33(13):1561.
[9] 部晓丽,张继星,范伟全长白山红景天配伍抗疲劳作用实验研究内蒙古民族大学学报自然科学版,2008,(04):452-456
[10] MAO GX,DengHB,YuanLG,LiYY,WangZ.Protective role of salidroside against aging in a mouse model induced by D-galactose. Biomedical and Environmental Sciences,2010,23(2):161-166.
[11] 张早华,陈琴音,周晓蓉,等.狭叶红景天预防高原反应的研究[J].中药材,1989,12(11):37-38.
[12]郑志清,叶于蔹,董妙珠,等.红景天抗辐射功能的初步实验研究[J].上海预防医学杂志,2000,12(2):70.
[13]薛丽君,金中初略醇对肝癌细胞的诱导及细胞增殖的抑制卫生毒理学杂志,2001,(02):106.
[14] 叶莎莎,曾耀英,尹乐乐红景天苷对小鼠腹腔巨嗟细胞体外增殖、调亡、吞嚼、ROS和NO产生的影响细胞与分了免疫学杂志,2011,27(3):237-41.
[15] 黄钰芳.红景天活性成分及药理作用中医药临床杂志,2008,(05):528.

关注本网官方微信 随时订阅权威资讯

