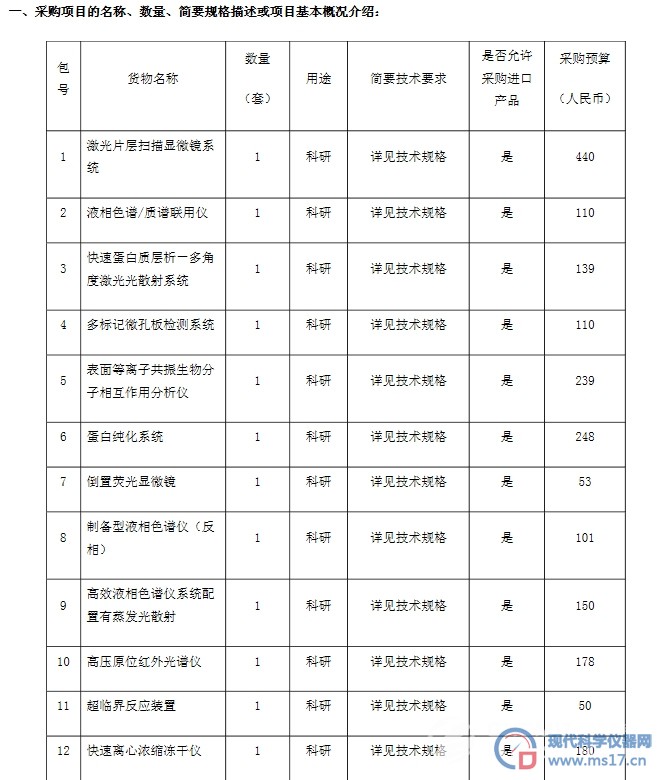
安捷伦科技推出新测定法诊断胃癌或胃食管结癌症
【核心介绍】名企动态安捷伦科技公司(NYSE:A)9月22日宣布推出其DakoPD-L1IHC22C3p
名企动态安捷伦科技公司(NYSE:A)9月22日宣布推出其Dako PD-L1 IHC 22C3 pharmDx测定法,其具有美国食品和药物管理局(FDA)批准的扩展标签,用于帮助识别胃癌或GEJ腺癌患者进行治疗KEYTRUDA®(pembrolizumab),由Merck&Co.,Inc.,Kenilworth,NJ,USA制造的抗PD-1疗法(在美国和加拿大以外称为MSD)。
FDA还于9月22日宣布,KEYTRUDA现已被批准用于治疗复发性局部晚期或转移性胃癌或胃食管癌(GEJ)腺癌的患者。这些肿瘤表达通过FDA批准的测试确定的PD-L1 [组合阳性得分(CPS)≥1],其中两个或更多个以前的治疗线上或之后的疾病进展,包括含氟嘧啶和含铂化疗,如果合适,HER2 / neu靶向治疗。
PD-L1 IHC 22C3 pharmDx和KEYTRUDA的扩大批准意味着这些患者现在有可能接受靶向抗PD-1免疫治疗。
胃癌是全球第五大常见恶性肿瘤,也是癌症死亡的第三大常见原因。诊断为晚期IV期胃癌的患者的预后差,只有4%的5年观察到的生存率*。以前,胃腺癌或GEJ腺癌患者治疗方案很少,其中包括高毒性化疗。
美国FDA于2015年10月首次批准,用于确定NSCLC,PD-L1 IHC 22C3患者的PD-L1表达水平,pharmDx是首例经FDA批准的用于鉴定胃腺癌或GEJ腺癌患者PD-L1表达的检测方法用于治疗抗PD-1治疗的KEYTRUDA。
“我们很高兴美国FDA批准扩展PD-L1 IHC 22C3 pharmDx测定的用途,因为它给患者胃癌或GEJ癌症患者的肿瘤样本测试PD-L1表达,并确定治疗资格使用KEYTRUDA“,安捷伦诊断和基因组学总裁Jacob Thaysen说。
在KEYNOTE-059试验中,使用PD-L1 IHC 22C3 pharmDx来评估用KEYTRUDA治疗的患者中的PD-L1表达。KEYNOTE-059是一项注册,第二阶段,全球性,多中心,非随机,开放标签的多药物试验,研究在晚期胃癌或GEJ腺癌患者中使用KEYTRUDA。
PD-L1 IHC 22C3 pharmDx是与Merck&Co.,Inc.,Kenilworth,美国新泽西州合作开发的,用于抗PD-1治疗的KEYTRUDA。
KEYTRUDA是一种人源化单克隆抗体,通过增加身体的免疫系统帮助检测和对抗肿瘤细胞的能力起作用。KEYTRUDA阻断PD-1与其配体PD-L1和PD-L2之间的相互作用,从而激活可能影响肿瘤细胞和健康细胞的T淋巴细胞。
安捷伦是与制药公司合作开发基于免疫组织化学的癌症治疗诊断的全球领导者。
编辑点评
胃癌是全球第五大常见恶性肿瘤,也是癌症死亡的第三大常见原因。以前,胃腺癌或GEJ腺癌患者治疗方案很少,其中包括高毒性化疗。安捷伦科技推出其Dako PD-L1 IHC 22C3 pharmDx测定法,用于帮助识别胃癌或GEJ腺癌患者进行治疗,将有助于提高患者的存活率,是临床诊断领域的一大重要突破。
(原标题:安捷伦科技获得扩大的FDA批准使用Dako PD-L1 IHC 22C3 pharmDx伴侣诊断胃癌或胃食管结(GEJ)癌症) (来源:安捷伦科技)
名企动态安捷伦科技公司(NYSE:A)9月22日宣布推出其Dako PD-L1 IHC 22C3 pharmDx测定法,其具有美国食品和药物管理局(FDA)批准的扩展标签,用于帮助识别胃癌或GEJ腺癌患者进行治疗KEYTRUDA®(pembrolizumab),由Merck&Co.,Inc.,Kenilworth,NJ,USA制造的抗PD-1疗法(在美国和加拿大以外称为MSD)。
FDA还于9月22日宣布,KEYTRUDA现已被批准用于治疗复发性局部晚期或转移性胃癌或胃食管癌(GEJ)腺癌的患者。这些肿瘤表达通过FDA批准的测试确定的PD-L1 [组合阳性得分(CPS)≥1],其中两个或更多个以前的治疗线上或之后的疾病进展,包括含氟嘧啶和含铂化疗,如果合适,HER2 / neu靶向治疗。
PD-L1 IHC 22C3 pharmDx和KEYTRUDA的扩大批准意味着这些患者现在有可能接受靶向抗PD-1免疫治疗。
胃癌是全球第五大常见恶性肿瘤,也是癌症死亡的第三大常见原因。诊断为晚期IV期胃癌的患者的预后差,只有4%的5年观察到的生存率*。以前,胃腺癌或GEJ腺癌患者治疗方案很少,其中包括高毒性化疗。
美国FDA于2015年10月首次批准,用于确定NSCLC,PD-L1 IHC 22C3患者的PD-L1表达水平,pharmDx是首例经FDA批准的用于鉴定胃腺癌或GEJ腺癌患者PD-L1表达的检测方法用于治疗抗PD-1治疗的KEYTRUDA。
“我们很高兴美国FDA批准扩展PD-L1 IHC 22C3 pharmDx测定的用途,因为它给患者胃癌或GEJ癌症患者的肿瘤样本测试PD-L1表达,并确定治疗资格使用KEYTRUDA“,安捷伦诊断和基因组学总裁Jacob Thaysen说。
在KEYNOTE-059试验中,使用PD-L1 IHC 22C3 pharmDx来评估用KEYTRUDA治疗的患者中的PD-L1表达。KEYNOTE-059是一项注册,第二阶段,全球性,多中心,非随机,开放标签的多药物试验,研究在晚期胃癌或GEJ腺癌患者中使用KEYTRUDA。
PD-L1 IHC 22C3 pharmDx是与Merck&Co.,Inc.,Kenilworth,美国新泽西州合作开发的,用于抗PD-1治疗的KEYTRUDA。
KEYTRUDA是一种人源化单克隆抗体,通过增加身体的免疫系统帮助检测和对抗肿瘤细胞的能力起作用。KEYTRUDA阻断PD-1与其配体PD-L1和PD-L2之间的相互作用,从而激活可能影响肿瘤细胞和健康细胞的T淋巴细胞。
安捷伦是与制药公司合作开发基于免疫组织化学的癌症治疗诊断的全球领导者。
编辑点评
胃癌是全球第五大常见恶性肿瘤,也是癌症死亡的第三大常见原因。以前,胃腺癌或GEJ腺癌患者治疗方案很少,其中包括高毒性化疗。安捷伦科技推出其Dako PD-L1 IHC 22C3 pharmDx测定法,用于帮助识别胃癌或GEJ腺癌患者进行治疗,将有助于提高患者的存活率,是临床诊断领域的一大重要突破。
(原标题:安捷伦科技获得扩大的FDA批准使用Dako PD-L1 IHC 22C3 pharmDx伴侣诊断胃癌或胃食管结(GEJ)癌症) (来源:安捷伦科技)

关注本网官方微信 随时订阅权威资讯