体外诊断试剂医疗器械项目风险管理研究
体外诊断试剂医疗器械项目风险管理研究
吕寻伟
北京怀柔医院 器械科,北京怀柔 101400
摘 要 目的:探讨体外诊断试剂医疗器械项目风险管理。方法:本次研究结合我院实际管理的状况,在采用医疗设备质量管理体系方法的基础上,分析体外诊断试剂医疗器械的管理重点,并根据实际管理过程中存在的问题和缺陷提出相应的解决办法。结果:需要建立体外诊断试剂临床试验风险管理体系,在风险识别阶段、定性分析阶段以及风险应对阶段对其中存在的问题进行有针对性的处理,从而形成一个具有可操作性的监督管理方法,防范于未然,尽可能地避免风险的发生。结论:体外诊断试剂医疗器械项目风险管理方法能够在一定程度上控制体外诊断试剂在医院的合理使用,确保试验过程及试验结果的安全性和有效性,为我院医疗器械管理部门的有效监督打下基础。
关键词 体外诊断试剂;医疗器械;项目风险管理
中图分类号 R197.39
Research on Project Risk Management of Medical Device Industry in Vitro Diagnostic Reagents
Lv Xunwei
QiXieKe of Beijing Huairou Hospital, Huairou, Beijing 101400
Abstract Objective: The risk management of medical equipment in the in vitro diagnostic reagent is discussed. Methods: based on the medical equipment quality management system and combined with management of the actual situation, this study analyzed the medical equipment management of the in vitro diagnostic reagents, put forward corresponding solutions according to the problems and defects existing in the actual management of the process. Results: It is needed to establish the risk management system of in vitro diagnostic reagents for clinical trials. In stages of risk identification, qualitative analysis and risk response, the existent problems are processed, thus operation supervision and management methods are formed to avoid risk. Conclusion: In vitro diagnostic reagents, medical equipment project risk management methods can control the rational use of in vitro diagnostic reagents in hospital in a certain extent, it can ensure the safety and effectiveness of the test process and test results, thus lay a foundation for the effective supervision of medical apparatus and instruments in hospital management.
Key words In vitro diagnostic reagents; Medical equipment; Project risk management
随着现代临床检验学的发展和临床诊断的进步,体外诊断试剂因其成本低、操作简单以及具有特异性等特点成为了临床疾病诊断和预警的有效方法。体外诊断试剂主要是采用免疫学、生物化学以及微生物学等原理或者相关的方法制备,主要用途是对人体某些疾病进行诊断和筛查,所以体外诊断试剂质量的好坏能在一定程度上影响检验诊断结果正确及可靠性,甚至能对临床医生在判断患者病情过程中造成直接影响。体外诊断试剂属于医疗器械管理,为了能进一步加强对体外诊断试剂临床试验的管理,我国颁布了一系列的管理规定,明确了体外诊断试剂的用途和最终目的。体外诊断试剂具有非常广阔的市场前景,但利润越大也就代表风险越大,为了确保其检测结果的准确性不会对医生诊断和患者健康造成直接影响,就需要对体外诊断试剂进行风险管理。本文结合我院实际管理的状况,在采用医疗设备质量管理体系方法的基础上,分析体外诊断试剂医疗器械的管理重点,并根据实际管理过程中存在的问题和缺陷提出相应的解决办法。
1 管理特点
目前体外诊断试剂还属于较为特殊的医疗器械,与临床上普通医疗器械据具有相同的临床试验分类。一般来说,按照风险程度可以将医疗器械临床试验分为三个等次,主要用于肿瘤和辅助诊断以及对治疗过程进行监测等产品,均属于第三类。我院医疗器械管理工作的特点主要如下。
1.1 种类繁杂
按照我国食品药品监督管理局对体外诊断试剂的规定,三类体外诊断试剂一共包括21项。目前,我院注册的体外诊断试剂在2000种左右,这些体外诊断试剂几乎包括了医疗器械临床试验的所有项目。在这些项目中,即便是用于同一部位的一类肿瘤诊断试剂,根据肿瘤检测过程中的敏感性以及医护人员在临床检测过程中的实际工作需要,又包含了许多不同的肿瘤标志物,并且这些不同的肿瘤标志物均是按照一个临床试验项目报告及注册,从而造成产品种类及项目的繁杂。具体项目内容如表1所示。
表1 部分肿瘤标志物项目
|
检测名称 |
肿瘤标志物名称 |
|
乳腺癌 |
CA27.29 CA153 β2-MG CA549 MCA CEA多胺CA125 |
|
宫颈癌 |
β2-MG SCC CA153 HSV-2 CYFRA21-1 |
|
胃癌 |
CA199 GST MG-7A CA50 CA242 CA724 胃泌素 GPDA ALP胎盘型 CEA β2-MG CA153 |
|
胰腺癌 |
LAP DU-PAN-2 LIP HPEI Amy CA19-9 CA724 CA242 CA50 CA153 CA125 |
|
白血病 |
β2-MG SF ALP胎盘型 LDH 多胺 GASA Se Go Zn Cu |
|
女性生殖系统 |
HCG SF AFP 粘蛋白 |
|
前列腺癌 |
f-PSA PSA ALP PAP |
|
鼻咽癌 |
EB病毒 |
|
大肠癌 |
CEA ODC |
|
卵巢癌 |
CEA CA125 CA153 CA549 CA724 LDH同工酶 ALP胎盘型 CA199 MCA |
|
膀胱癌 |
CYFRA21-1 |
|
结直肠癌 |
CEA CA19-9 CA724 CA242 GST CA153 β2-MG |
|
甲状腺癌 |
TSH CT |
|
肺癌 |
LDH同工酶 CEA TPA CA125 AAT CA153 CT Zn SCLC NSCLC |
1.2 收费杂
体外诊断试剂在管理的过程中需要严格遵守许多相关的规定和管理办法,并且还需要根据医院开展器械临床试验进行评审工作,其中包括送审材料及费用清单,在费用清单中需要明确费用类别,按照财务管理规定全部纳入院财务进行统一管理。
1.3 试验样本多
一般来说,第三类体外诊断试剂在临床试验的过程中需要400例以上的检测样本,第二类需要100例以上的检测样本。完成试验后由于原始数据量过于庞大,使得核查工作量非常大,并且一旦试剂进入临床,是无法对其使用状况进行逐一的监督。除此之外,由于接受体外诊断试剂试验的患者不需要签署知情同意书,因此就无法对样本的来源进行确认。
2 风险评估表及风险管理流程
2.1 风险评估表
表2 风险评估表
风险类型
风险内容
系统风险
政策风险
国家法律或政策变动
法律风险
法律完善程度及技术侵权
非系统风险
决策风险
调研不够全面
技术风险
技术不成熟
管理风险
资源分配及计划安排
市场风险
供需关系
质量风险
原材料及产品质量
人力风险
人员素质和稳定性
2.2 风险管理流程
风险管理体系中一共可以分为风险识别、定性分析、风险应对三个阶段,每个阶段的应对方法如下:①风险识别阶段。应该根据体外诊断试剂自身的特点,在生命周期内分解项目工作结构,在此过程中可以采用头脑风暴法的方式分析项目风险,然后再结合整个项目开发的流程去识别可能存在的风险源。这种方式能够使每个项目阶段的人员在实际工作的过程中有意识的识别风险,以便更好地促进工作的开展。②定性分析阶段。在此阶段项目管理人员应该能够初步认识项目开展过程中风险发生的概率及影响程度,对可能发生的风险采用层次分析法得出量化数据,从而能直观地对项目风险的初步等级进行排序。主要目的在于对风险的影响程度进行准确地判断,更好地了解和掌握其中存在的主要风险源。③风险应对阶段。在此过程中,风险管理人员需要根据风险的种类和级别进行有针对性的处理措施。比如在面对非系统风险的过程中,我们可以对其采取风险规避及风险转移;而在面对系统风险的过程中,风险管理人员可以根据风险的特点及原因采取风险减轻及自留的方式,然后将风险进行细化,并将其分到项目的各个阶段中,主要从具体的风险因素着手对其进行有针对性的应对措施和处理方法。体外诊断试剂医疗器械项目风险管理的控制要点主要体现为:
1、风险管理人员应该建立科学合理的决策体系,在建立的过程中应该充分地利用各种可以获得的信息,科学立项。
2、风险管理人员在建立技术体系的过程中需要结合企业的自身实力,将重点放在技术的更新与匹配上,对于开发项目应该选择有把控的风险项目,尽可能地降低风险的发生。
3、风险管理人员应该是一支行之有效的工作团队,建立健全有利于维护人员稳定的激励机制,为其创造一个良好的发展氛围,防止人才流失。
4、风险管理人员应该建立一个科学有效的进度掌握及管理系统,主要目的在于确保项目开发的高效率,并且能够严格地控制项目开发的节奏和进程。
5、风险管理人员应该建立科学合理的项目资源分配体系,对各个阶段的项目预算进行良好的把控,能够有计划有目的的对人员、设备、费用以及原材料等各类资源进行分配。
6、风险管理人员还需要对风险管理文档引起足够的重视,在日常管理中做到及时记录和存档。
体外诊断试剂医疗器械项目风险管理流程如图1所示。
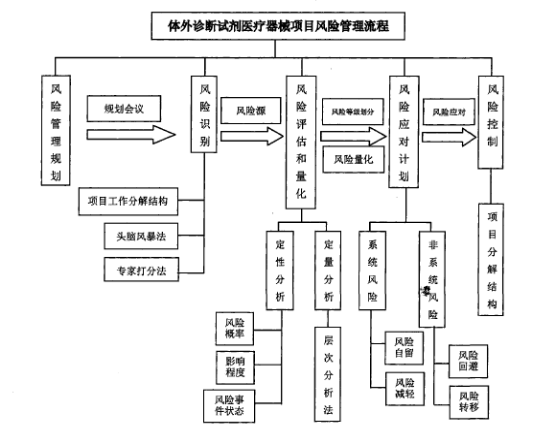
图1 体外诊断试剂医疗器械项目风险管理流程
3 讨论
从上世纪90年代中期开始,国际标准化组织便订制了医疗器械风险管理的相关标准,并且之后联合国际电工委员会对医疗器械风险管理进行三次修改和换版,从而此规章制度便成为了国际公认的准则。2008年国家食品药品监督管理局发布并实施了《医疗器械--风险管理对医疗器械的应用》,在这个管理条例中对各国医疗器械风险管理的方法及经验进行了更深一步的总结,对风险管理的范围、过程以及方法进行了明确。除此之外,加拿大、美国等国家和地区也颁布了各自的法规,并且还要求医疗器械生产厂商严格进行风险管理措施。在此过程中,世界各国主要通过制定相关标准为医疗器械生产商提供管理框架,从而进行风险管理。各国政府在对医疗器械生产商的产品进行质量审核的过程中,会要求提供管理活动记录。
而我国在医疗风险管理上,对于其相关的理论和技术方法尚处于学习以及吸收国外优秀成果的阶段。目前,对于医疗器械风险管理的研究主要是讨论医疗器械风险管理的法律法规,然后在此基础上结合医疗器械风险管理的实际情况,对实际管理过程中出现的问题进行分析并提出相关建议。但目前我国并没有深入地对医疗器械风险管理进行研究,仅仅只是停留在较为浅显的阶段,缺乏对风险管理的重视。
综上所述,体外诊断试剂医疗器械风险管理需要管理人员不断地进行学习和总结,体外诊断试剂因其使用便捷、费用低等特点越来越受到人们的青睐。但需要医院器械管理部门进行严格的管理和控制,确保试验过程及试验结果的安全性和有效性,为我院医疗器械管理部门的有效监督打下基础。
参考文献
[1]黄亮,朱江华,顾海怡等.浅谈体外诊断试剂管理[J].中国医疗器械杂志,2015,39(3):232-234.
[2]孙嵘,薛玲,于泳等.体外诊断试剂分类目录编制工作的必要性和现实意义[J].首都医药,2012,33(16):4-6.
[3]李耀华.POCT 类体外诊断试剂注册技术要求解析[J].中华检验医学杂志,2014,24(11):812-816.
[4]陈立星,高小坤.医院体外诊断试剂冷链管理初探[J].国际检验医学杂志,2012,33(21):2672-2673.
[5]北京市药品监督管理局医疗器械处,北京市药品监督管理局医疗器械技术审评中心.医疗器械生产质量管理体系相关问题解析[J].首都医药,2012,16(24):4-5.
[6]田少雷.体外诊断试剂质量管理体系考核现场检查的程序和方法[J].中国医疗器械杂志,2010,34(2):129-132.
[7]赵阳,薛玲,孙嵘等.体外诊断试剂分类子目录编制及要点解析[J].首都医药,2013,20(2):4.
[8]吕允凤.体外诊断试剂注册管理政策解读[J].中国医疗器械信息,2014,09(12):1-3,48.
[9]刘艳,孙楠,王玉梅等.体外诊断试剂行业标准制定工作的现状分析及展望[J].中国医疗器械杂志,2014,38(6):448-450.
[10]裘敏杰,董耿,徐晓媛等.无注册证但临床急需的体外诊断试剂现状及其对策[J].中国医疗器械杂志,2015,16(5):356-357,366.
[11]赵阳.北京市医疗器械技术审评中心完成国家“863”项目心脑血管慢性损伤及急救指标等体外诊断试剂研制课题任务[J].中国医疗器械信息,2014,22(11):67-68.
[12]吕允凤.新法规体系下体外诊断试剂类产品临床试验要求的变化[J].中国医疗器械信息,2014,23(12):4-6,52.
[13]杨勇,雷孝锋,李尔华等.《体外诊断试剂注册管理办法》解读[J].分子诊断与治疗杂志,2015,7(4):286-288.
[14]田少雷.对我国体外诊断试剂质量管理体系考核中发现问题的统计分析[J].中国医疗器械杂志,2012,09(6):433-437.

关注本网官方微信 随时订阅权威资讯