醋酸质量对CE-MS测定蛋白质肽图谱图质量的影响
醋酸质量对CE-MS测定蛋白质肽图谱图质量的影响
李晓,徐延昭*
(中国食品药品检定研究院,北京100050)
摘要目的:考察醋酸质量对CE-MS结果的影响。方法:在使用不同级别的醋酸条件下,进口高质量分析纯和LC-MS级别醋酸,采用CE-MS分析蛋白质质量肽图。结论:本文对比了进口高质量分析纯醋酸和LC-MS级别醋酸在CE-MS分析蛋白质肽图时的影响。在空白实验中,LC-MS级醋酸的TIE波动程度约为分析纯醋酸的一半;对比谱图基线发现,采用LC-MS级别醋酸在m/z=400处基线高度仅为基峰的5%,但是如果采用分析纯醋酸,该处基线高度可达基峰的20%,基线噪音提高4倍;在BSA实验组中,分析纯醋酸组灵敏度为采用LC-MS级别醋酸的1/2-1/3。因此,LC-MS级试剂是毛细管电泳质谱联用技术的首选。
关键词毛细管电泳质谱联用;醋酸质量;灵敏度
中图分类号O657.63
Effect of Acetic Acid Quality for Determination of Protein Peptide Mapping by Capillary Electrophoresis-Mass Spectrometry
Li Xiao, Xu Yanzhao *
(National Institutes for Food and Drug Control, Beijing 100050, China)
Abstract Objective: Studying the effect of acetic acid quality of CE-MS results. Methods: Under the condition of the use of different levels of acetic acid, high quality analytically pure level and LC-MS level acetic acid were imported, the protein peptide mapping was analyzed by CE-MS. Conclusion: In this article, we compared the influence of the imported high quality analytically pure level and LC-MS level acetic acid in the CE-MS analysis protein peptide mapping. In blank experiment, TIE volatility of LC-MS level acetic acid is about half of the analytically pure acetic acid. Comparingthe chromatogram baseline, the LC-MS level of acetic acid in the m/z=400 baseline height was only about 5% of the base peak, but if pure acetic acid is analyzed, the baseline height can be up to 20% of the base peak, four times baseline noise increases. In the BSA experimental group, the sensitivity of the analytically pure group was 1/2-1/3 of the LC - MS group.So LC - MS level reagent is the first selection of CE-MS technology.
Key words: Capillary electrophoresis-mass spectrometry: The quality of acetic acid; Sensitivity
质谱是目前药物分析中最强的分析和鉴定手段之一,极高的灵敏度和对牛血清有较强的抗干扰能力,使其得到了广泛的应用。目前液相色谱(LC)是分析人员最常用的质谱前分离手段,无论是化学药还是生物药的检测中,液相色谱质谱联用(LC-MS)都有着十分广泛的应用[1-4]。毛细管电泳是一种高效的分离分析模式,在药物检测领域有着越来越广泛的应用,多个基于毛细管电泳的方法已经被收入各个药典中[5-7]。由于分离原理不同,将毛细管电泳作为与质谱联用的前分离手段,可以解决很多LC-MS不易解决的问题,并可以提供不同分离原理的正交验证数据。
目前重组蛋白质药物是生物医药领域最热门的产品。产生了很多十分重要的药物。因此无论是仿制药还是原研药,重组蛋白质药物的研究都如火如荼的进行着。由于蛋白质药物的复杂性,其对表征手段要求也远高于普通化学药物[8-10]。对蛋白质药物肽图的表征是确定其序列和翻译后修饰的主要手段。常规情况下,研究人员均通过LC-MS方法进行肽图分析[11-14]。而毛细管电泳质谱联用(CE-MS)可以提供一种依据肽段的电荷质量比分离的正交于LC-MS的分离手段。同时由于CE采用空毛细管进行分离,因此在肽图分析过程中基本无残留。此外,由于翻译后修饰肽段所带电荷通常不同于未修饰肽段,因此CE-MS十分适合分析蛋白质药物的翻译后修饰和序列变异[15-16]。
目前CE-MS常用的分析条件是采用低于10%的醋酸作为分析缓冲液。由于对试剂质量重要性的认识不足,实验人员通常倾向于选择进口分析纯试剂,认为其标称纯度与LC-MS近似但价格相对便宜,是高性价比选择。据作者所知,截至目前为止,并没有人考察过醋酸质量对CE-MS结果的影响。
本文考察了进口的分析纯醋酸和LC-MS级醋酸对CE-MS空白和分析蛋白质肽图时的影响。实验结果表明,由于使用的CE-MS接口灵敏度提高,即使是使用进口分析纯醋酸,仍会带来一定的干扰,其灵敏度为采用LC-MS级醋酸的1/2-1/3。因此建议选用LC-MS级醋酸,以确保高质量的实验结果,尤其是在检测低含量的翻译后修饰肽段过程中使用LC-MS级醋酸是十分重要。
1 材料与方法
1.1 样品
牛血清白蛋白购自Sigma公司
1.2 主要仪器及试剂
本文所有实验均采用ECE-001型毛细管电泳仪(CMP Scientific, Corp. ),质谱为thermofisher公司orbitrap XL型高分辨质谱仪。联用接口采用CE-MS离子源: EMASS-II型毛细管电泳与电喷雾质谱联用离子源 (CMP Scientific, Corp.)。实验用毛细管为CMP公司CE-MS专用毛细管,外径360微米,内经50微米,内壁未经涂层,在毛细管出口端采用特殊方式进行了刻蚀,使外径缩小到150微米左右,从而保证质谱接口处可以达到零死体积,最大程度上保证毛细管电泳的高分辨率不受影响。
本文所用水和醋酸均购自sigma Aldrich,其中水为LC-MS级别,醋酸分为LC-MS和分析纯两个级别。BSA酶解产物标准品由CMP公司提供。
1.3 方法
毛细管电泳质谱联用检测条件:实验以5%醋酸为分离缓冲液,鞘液采用加入0.5%甲酸的10%甲醇水溶液。毛细管长度50厘米,分离电压20 kV。实验均采用压力进样,0.3 psi,7s。电喷雾电压1.8 kV,由离子源自带电源提供。
2 结果
由于毛细管电泳质谱联用系统所需试剂量较小,且早期接口灵敏度较差,因此实验人员往往对试剂质量不够重视。采用醋酸等试剂时多用分析纯试剂,而未见不良反应报道。但是由于目前新型CE-MS接口纷纷问世,灵敏度有两至三个数量级的提升[17-19],因此试剂中的微量杂质影响开始越来越显著的体现出来。
首先对采用不同醋酸的空白实验结果进行考察。首先考察了LC-MS级醋酸和分析纯醋酸对CE-MS空白实验总离子流图(TIE)的影响,如图1所示,两种醋酸的TIE谱图强度相似,也都比较平稳。但更细致的观察时发现:采用LC-MS级醋酸的TIE波动程度约为分析纯醋酸的一半,说明在此条件下接口喷雾更稳定,更能得到好的实验结果。

图1 采用不同纯度醋酸的CE-MS总离子流图(TIE)。上图是采用LC-MS级醋酸的TIE图,下图是采用分析纯醋酸的TIE图。
接下来进一步考察了两种醋酸的CE-MS空白质谱图,结果如图2所示。我们选取了0-7 min范围内质谱做平均,谱图中基峰均是m/z=371的离子,峰高度均在5e4左右,主要离子m/z=371和m/z=445等相应强度也相似。但是,当对比谱图基线时发现,采用LC-MS级别醋酸在m/z=400处基线高度仅为基峰的5%,但是如果采用分析纯醋酸,该处基线高度可达基峰的20%,基线噪音提高4倍,将对灵敏度造成显著影响。同时由于离子源的离子化效率限制,基线变高还会影响待测离子的离子化效率,从而进一步影响检测灵敏度。

图2 采用不同纯度醋酸的空白质谱图。
上图是采用LC-MS级醋酸的结果,下图是采用分析纯醋酸的结果。
为了进一步验证上述结果,接下来用两种醋酸进行了BSA酶解产物标准品的肽谱分析,如图3所示。从基峰电泳图(BPE)中可以看出,出峰比较靠前的6-12.5 min出峰时间基本相同,但是12.5-17 min处峰强度明显降低,峰形状也有所变化。说明采用分析纯醋酸会影响部分肽段的检测灵敏度。

图3,采用不同纯度醋酸时CE-MS分析牛血清白蛋白酶解产物肽谱。上图是采用LC-MS级醋酸的结果,下图是采用分析纯醋酸的结果
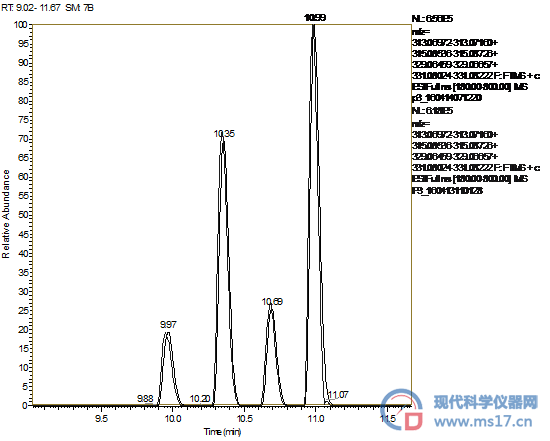
接下来选取了三个不同出峰时间的多肽进一步验证不同醋酸的影响。肽段的序列和带电状态等信息见表1。三个多肽的出峰时间分别为8.46 min,14.29 min和17.48min,前两个峰的情况见图4。其中8.46 min的峰面积差别不大。说明对出峰前段的多肽的信号影响并不是很大。当观察出峰时间在14.29 min的多肽则出现了比较大的差别,采用分析纯醋酸的峰面积仅为使用LC-MS级的峰面积的37.6%。而对于出峰时间在17.48的多肽,由于其强度较低,重新提取了一张谱图,见图5。采用LC-MS级醋酸时峰面积是采用分析纯醋酸的2.5倍。从以上结果可以看出,无论对高含量组分还是低含量组分,醋酸纯度对峰面积均有较大的影响,选用高纯度醋酸对CE-MS实验,尤其是定量实验至关重要。
表1,三种牛血清白蛋白肽段CE-MS结果。
|
序列 |
质核比(m/z) |
电荷 |
迁移时间 |
峰面积(LCMS级醋酸) |
峰面积(分析纯醋酸) |
|
KVPQVSTPTLVEVSR |
547.32 |
3 |
8.46 |
1.35E8 |
1.40E8 |
|
IKQNCDQF |
1052.40 |
1 |
14.29 |
4.81E7 |
1.81E7 |
|
VDKCCAADDKEACFAVEGPK |
1135.03 |
2 |
17.48 |
6.24E6 |
2.46E6 |

图4,肽段KVPQVSTPTLVEVSR(m/z=547.32)和IKQNCDQF(m/z=1052.40)的提取离子电泳图。上图是采用LC-MS级醋酸的结果,下图是采用分析纯醋酸的结果

图5,肽段VDKCCAADDKEACFAVEGPK(m/z1135.03)的提取离子电泳图。
上图是采用LC-MS级醋酸的结果,下图是采用分析纯醋酸的结果
3 讨论
首次考察了不同纯度级别的醋酸对CE-MS实验结果的影响。结论表明,虽然同样是进口高纯度试剂,LC-MS级的醋酸比分析纯的醋酸可以提供更高的灵敏度,更稳定的电喷雾,从而帮助实验人员得到更好实验结果。
参考文献
[1] 关瑾, 许文雅, 阎峰,等. 液相色谱-质谱联用技术在药物代谢组学研究中的应用进展[J]. 药物分析杂志, 2016(1): 9-16.
[2] 张齐家, 孙文军. 串联质谱及液质联用技术在药物分析研究中的应用[J]. 中医药学报, 2009, 37(6): 23-29.
[3] SCHIEL JE, AU J, HE HJ. LC-MS/MS biopharmaceutical glycoanalysis: identification of desirable reference material characteristics.[J]. Anal Bioanal Chem, 2012, 403(8):2279-89.
[4] HOPFGARTNER G, LESUR A, VARESIO E. Analysis of biopharmaceutical proteins in biological matrices by LC-MS/MS II. LC-MS/MS analysis[J]. Trac Trends in Analytical Chemistry, 2013, 48(1):52-61.
[5] QI Y, LI Y, BAO JJ. Development of a CE method analyzing ADA and PNP and its application in inhibitor screening[J]. Anal Biochem. 2016 2697(16): 30064-71.
[6] XU Z, YE F, WANG Y, et al. Pressure-assisted electrokinetic injection stacking for citalopram drug to achieve highly sensitive detection and enantioseparation by capillary electrophoresis[J]. Se Pu. 2015, 33(9):988-94.
[7] FU X, XIAO H, LIANG S, et al. A method developed to fractionate intact proteins based on capillary electrophoresi[J]. Analyst. 2016, 141(1):305-10.
[8] FEDERICI M, LUBINIECKI A, MANIKWAR P, et al. Analytical lessons learned from selected therapeutic protein drug comparability studies[J]. Biologicals, 2013, 41(3):131-147.
[9] ZHANG Z, PAN H, CHEN X. Mass spectrometry for structural characterization of therapeutic antibodies[J]. Mass Spectrometry Reviews, 2009, 28(1):147-76.
[10] BECK A, WAGNER-ROUSSET E, AYOUB D, et al. Characterization of therapeutic antibodies and related products[J]. Analytical Chemistry, 2012, 85(2):715-36.
[11] ZHANG J, QIN T, XU L, et al. Development and Validation of a Peptide Mapping Method for the Characterization of Adalimumab with QDaDetector[J]. Chromatographia, 2016:1-9.
[12] WANG Y, LI H, SHAMEEM M, et al. Development of a sample preparation method for monitoring correct disulfide linkages of monoclonal antibodies by liquid chromatography–mass spectrometry[J]. Analytical Biochemistry, 2016, 495:21-28.
[13] BonGERS J, CUMMINGS J M, FEDERICI M, et al. Validation of a peptide mapping method for a therapeutic monoclonal antibody: what could we possibly learn about a method we have run 100 times[J]. Journal of Pharmaceutical & Biomedical Analysis, 2000, 21(6):1099-1128.
[14] DICK L W, MAHON D, QIU D, et al. Peptide mapping of therapeutic monoclonal antibodies: Improvements for increased speed and fewer artifacts[J]. Journal of Chromatography B, 2009, 877(3):230-236.
[15] LEW C, GALLEGOS-PEREZ JL, FonSLOW B, et al. Rapid level-3 characterization of therapeutic antibodies by capillary electrophoresis electrospray ionization mass spectrometry[J]. J Chromatogr Sci. 2015, 53(3):443-9..
[16] WANG Y, LI H, SHAMEEM M, et al. V Development of a sample preparation method for monitoring correct disulfide linkages of monoclonal antibodies by liquid chromatography-mass spectrometry[J]. Anal Biochem. 2016 , 495(1):21-8.
[17] RAMAUTAR R, HEEMSKERK AM, HENSBERGEN P J, et al. CE–MS for proteomics: Advances in interface development and application[J]. Journal of Proteomics, 2012, 75(13):3814-28.
[18] DOVICHI N, WOJCIK R. SHEATH-FLOW ELECTROSPRAY INTERFACE: US, US20130140180[P]. 2013.
[19] YAN X, SUN L. Bottom-up proteome analysis of E. coli, using capillary zone electrophoresis-tandem mass spectrometry with an electrokinetic sheath-flow electrospray interface[J]. Proteomics, 2013, 13(17):2546-51.

关注本网官方微信 随时订阅权威资讯